[2012·太原二模]在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH的物质的量为b mol。下列叙述中正确的是( )
| A.溶质的质量分数为w=×100% |
| B.溶质的物质的量浓度c= mol·L-1 |
| C.溶液中c(OH-)= mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
如图,烧杯中的溶质均足量,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出,以下说法正确的是()
| A.e电极上可以析出使湿润的淀粉KI试纸变蓝的气体 |
| B.c电极周围溶液变红 |
| C.A烧杯内Cu2+浓度降低 |
| D.B烧杯中加一定量的KCl固体可恢复原状 |
根据键能数据估算Si(s)+O2 (g)=SiO2(s)的反应热ΔH为 ()
| 化学键 |
Si—O |
Si-Si |
O=O |
Si-C |
| 键能/(kJ/mol) |
460 |
176 |
498 |
155[ |
A.–246 kJ · mol-1 B.+246 kJ · mol-1 C.–990 kJ · mol-1 D.+990 kJ · mol-1
下列叙述正确的是()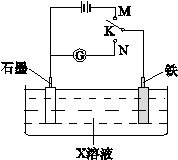
| A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 |
| B.K与M连接时,X为硫酸,一段时间后溶液的pH增大 |
| C.K与N连接时,X为氯化钠,石墨电极上的反应为:2H++2e—=H2↑ |
| D.K与M连接时,X为氯化钠,石墨电极上的反应为:4OH—-4e—=2H2O+O2↑ |
下列有关金属的腐蚀与防护的说法不正确的是()
| A.地下钢管连接镁块可以保护地下钢管 |
| B.纯银制品在空气中因化学腐蚀渐渐变暗 |
| C.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用 |
| D.水中的钢闸门连接电源的负极可以保护钢闸门 |
长式周期表共有18个纵行,从左到右排为1—18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是 ()
| A.s区元素都是金属元素 | B.第13列的元素原子最外层电子排布为ns2 np1 |
| C.第四周期第9列元素是铁元素 | D.第10、11列为ds区 |