已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是:( )
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、C e3+、Fe2+ e3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe3+、Sn2+、Ce3+ |
配制250 mL 1 mol·L-1的盐酸溶液时,下列实验操作使配制溶液浓度偏大的是( )
| A.定容时,仰视达到刻度线 |
| B.定容时,俯视达到刻度线 |
| C.量筒量取所需浓盐酸时,仰视达到刻度线 |
| D.量筒量取浓盐酸时,俯视达到刻度线 |
实验室配制1 mol·L-1盐酸250 mL,下列不需要的仪器是( )
| A.250 mL容量瓶 | B.托盘天平 |
| C.胶头滴管 | D.量筒 |
用25 g胆矾按下列要求分别配成溶液,所确定的浓度正确的是( )
| A.溶解在100 mL水中,浓度为1 mol·L-1 |
| B.溶解体积为100 mL,浓度为1 mol·L-1 |
| C.溶解在75 mL水中,浓度为25% |
| D.溶解在75 mL水中,浓度为16% |
100 mL 0.30 mol·L-1的Na2SO4溶液和50 mL 0.20 mol·L-1的Al2(SO4)3溶液混合后,溶液中的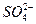 的物质的量浓度最接近于( )
的物质的量浓度最接近于( )
| A.0.20 mol·L-1 | B.0.25 mol·L-1 |
| C.0.40 mol·L-1 | D.0.50 mol·L-1 |
溶质的质量分数为14%的KOH溶液,经加热蒸发去100 g水后,质量分数变成28%,体积为80 mL,则此时溶液的物质的量浓度为( )
| A.5 mol·L-1 | B.6 mol·L-1 |
| C.6.25 mol·L-1 | D.6.75 mol·L-1 |