我国道教发源地山东威海圣经山摩崖石刻,为国内罕见的大型道教石刻,可称为瑰宝。圣经山摩崖石刻的材质是大理石,主要成分是碳酸钙,现在字迹已模糊不清。摩崖石刻被腐蚀,是否是酸雨所致?试回答下列问题:
(1)酸雨的成因:即使大气没有受到污染,正常的雨水或河水也呈微弱酸性(
在5.6~7之间),原因是
(2)定量实验探究:
查阅资料及定性实验表明:
(1)醋酸和酸雨的酸性程度差不多, 在5.6~3之间;
(2)酸雨(醋酸)确实能加重大理石腐蚀的程度;
(3)定性实验显示:将大理石放入
=3的醋酸溶液中,短时间内几乎看不出有气泡产生。
现提供下列仪器和试剂:
仪器:烧杯、托盘天平、镊子、量筒、胶头滴管。
药品:
=6.5的普通雨水、
=3醋酸溶液、大理石薄片。
请你设计一个"定量实验方案",证明摩崖石刻被腐蚀,主要与酸雨有关,与普通雨水无关。
| 实验内容及步骤 |
应得到的实验结果 |
(3)下列与保护摩崖石刻有关的说法中,你同意的是( )
A.了解哪种人类活动最容易引起酸雨
B.引起酸雨原因的结论应建立在科学研究的基础上
C.保护摩崖石刻要建立在有关损坏原因的科学证据的基础上
D.要从根本上预防酸雨的危害,应禁止工厂和汽车排放气体
E.要减少酸雨的危害,应研究和推广减少有害气体排放的技术
F.要从根本上保护摩崖石刻,主要应研究修复被酸雨损伤的摩崖石刻的方法与技术
用图装置探究相关问题: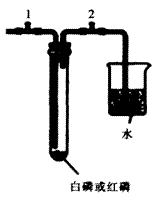
(1)检验装置的气密性。连接装置,关闭弹簧夹l、打开弹簧夹2。用酒精灯稍加热试管后,移去酒精灯,观察到现象:______________,说明装置气密性良好。
(2)取两套相同的装置,分别往试管中加入足量白磷、红磷后,连接仪器,关闭所有弹簧夹,再将两支试管同时放入同一热水中,观察到白磷燃烧,而红磷没有燃烧。可得到结论:
(3)试管中白磷燃烧一段时间后熄灭。撤去热水,仍关闭弹簧夹,待温度恢复到室温,打开弹簧夹2,可观察到的现象:让剩余白磷在水中继续燃烧的方法:
(4)请用该装置设计实验,探究影响燃烧剧烈程度的因素(其他用品自选)。
你的猜想:影响燃烧剧烈程度的一种因素是___________________。
实验设计(要求:写出操作步骤,描述控制变量具体方案):__________________
同学们对实验“煅烧石灰石”展开了探究。资料:石灰石中的杂质高温不分解且不与稀盐酸反应
①为证明石灰石已分解,三位同学设计方案如下:
I.甲同学按图一所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式(1) 。
II.乙同学按图二所示进行实验,观察到B中液体变(2) 色,A实验的作用(3) 。
III.丙同学取一定质量的石灰石煅烧,一段时间后发现固体质量减轻,证明石灰石已分解。
你认为哪位同学的方案不合理?并写出理由(4) 。
②为证明石灰石是否完全分解?丁同学对丙同学煅烧后的固体又进行了如下探究
| 实验步骤 |
实验现象 |
结论 |
| (5) |
有气泡产生 |
石灰石未完全分解 |
实验室利用下图实验装置进行实验,回答下列问题:


①上图中仪器a的名称为(1) 。
②实验室用装置A制取氧气的化学方程式是(2) ,在上图右侧框内画出排气法收集氧气的装置示意图(3) 。
③实验室用过氧化氢溶液和二氧化锰制氧气时选用B装置为反应装置。实验中,同学们发现不能得到平稳的氧气流。大家提出从两个方面加以改进:
一是把发生装置由B改为(4) (填字母编号),其理由是(5) 。
二是将过氧化氢溶液加水稀释。若把50g 质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为(6) g。
④某同学为测定过氧化氢溶液中溶质质量分数,向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
| 反应前物质的质量/g |
充分反应后物质的质量/g |
|
| 过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
| 68.0 |
0.1 |
66.5 |
请计算:
I.该同学制得氧气的物质的量为(7) mol;
II.该同学所用过氧化氢溶液的溶质质量分数。(根据化学方程式列式计算)(8)
育才中学的某研究小组在探究维生素C水溶液的酸碱性时,不慎误把维C泡腾片(保健品。主要成分如图所示)当做维生素C片放入了水中,结果发现有大量气泡产生,于是引起了该小组同学的探究兴趣。
【提出问题】该气体成分是什么?
【猜想与假设】小青说:该气体可能含有CO2 、O2、 CO、 H2 、 N2 中的一种或几种。小丽说:不可能含有 N2,因为
小亮说:不可能含有H2 和CO,因为从药品安全角度考虑,H2易燃易爆,CO
最后研究小组的同学共同认为:该气体可能含有CO2、O2中的一种或两种。
【进行实验】
| 编号 |
实验操作 |
实验现象 |
| ① |
将气体通入澄清的石灰水 |
澄清石灰水变浑浊 |
| ② |
将带火星的木条伸入到该气体中 |
带火星的木条没有复燃 |
【得出结论】(1)由实验①可知,该气体中肯定含有 ,
(2)由实验② (填“能”或“不能”)确定该气体中不含氧气,理由是
铜是一种常用的金属,纯净的铜颜色为紫红色,它能够和硝酸银溶液发生化学反应,生成硝酸铜和银单质。某同学设计下表所示实验,探究金属铜对过氧化氢溶液分解速率的影响。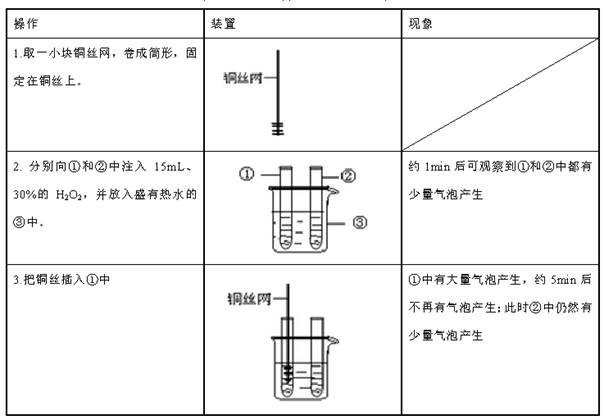
(1)仪器②中实验的目的是__________________;
(2)根据上述实验,可以得出的结论是 ;
(3)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是 。
| A.称量实验前铜丝网的质量 | B.将实验后的铜丝网干燥、称重 |
| C.向仪器中加入二氧化锰 | D.将实验后的铜丝网插入AgNO3 溶液中 |