铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有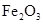 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
和温度(T)的关系示意图中与铝热反应最接近的是 。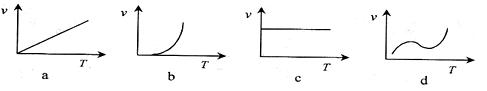
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
Fe(OH)3 + ClO- + == FeO42- + Cl- + ;
(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为
已知电极材料:铁.铜.银.石墨.锌.铝,电解质溶液:氯化铜溶液.硫酸铁溶液.盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。__________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线构成原电池,请写出电极反应式,负极,正极。
(3)若总反应为:Cu+2H+= Cu2++H2,判断该装置属于原电池还是电解池?____。画出对应的装置图,标出电极材料和电解质溶液。_____
有甲、乙两种物质: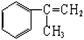
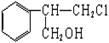
甲乙
(1)乙中含有的官能团的名称为____________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):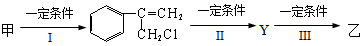
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为___________________________________(不需注明反应条件)。
(3)下列物质不能与乙反应的是(选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.氢氧化钠溶液
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色
某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)________。
a.C7H12O2b.C6H14c.C6H14Od.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
则A的结构简式为________________;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为__________________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为______________。
按要求填写:
(1)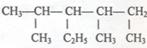 (系统命名)
(系统命名)
(2)(CH3)2CHCH(CH3)C≡CCH(CH3)2(系统命名)
(3)4,4,5-三甲基-2-己醇(写出结构简式)
根据下列4组物质的结构简式回答:
① CH4和CH3CH3② CH=CHCH3和CH3CH=CH2
③ ④ C2H5OH和CH3OCH3
④ C2H5OH和CH3OCH3
(1)属于同系物的是。(2)属于同一物质的是。
(3)具有不同官能团的同分异构体是。
(4)由于碳链骨架不同而产生的同分异构体是。