被称之为“软电池”的纸质电池,采用一个薄层纸片作为传 导体,在其一边镀锌,而在另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为
导体,在其一边镀锌,而在另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为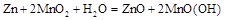 。下列说法正确的是( )
。下列说法正确的是( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
C.当0.1moZn完全溶解时,流经电解液的电子个数为1.201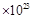 |
D.电池正极反应 为 为 |
下列离子方程式与所述事实相符且正确的是
| A.用食醋和淀粉—KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+=== 3I2+3H2O |
| B.稀HNO3溶液与难溶于水的FeS固体:FeS+2H+===Fe2++H2S↑ |
| C.碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3- +OH-=== CaCO3↓+ H2O |
| D.Na与水的反应Na + H2O=== Na++OH-+ H2↑ |
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
| A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) |
| C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
有硫酸镁溶液500 mL,它的密度是1.20 g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
| A.硫酸根离子的质量分数是19.2% |
| B.溶质的质量分数是24.0% |
| C.溶液的物质的量浓度是2.4 mol/L |
| D.溶质和溶剂的物质的量之比是1∶40 |
常温下,下列各组离子中,在给定条件下一定能够大量共存的是
| A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
| B.无色溶液中:Mg2+、MnO4-、SO42-、K+ |
| C.滴加紫色石蕊溶液显红色的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、SO42-、NO3- |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.8g18O2含有的中子数为5N A |
| B.1molFeI2与足量Cl2氯气充分反应转移的电子数为2NA |
| C.标准状况下22.4LNO与11.2LO2混合后的气体分子数约为NA |
| D.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |