“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101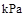 时:
时: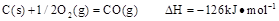
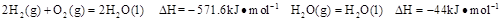
则在25℃,101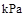 时:
时: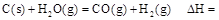 .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为: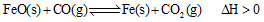 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的 平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,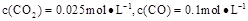 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用 来生产燃料甲醇
来生产燃料甲醇 ,有关反应为:
,有关反应为: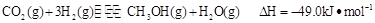 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol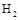 ,反应过程中测得
,反应过程中测得 和
和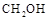 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。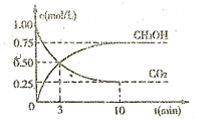
①从反应开始到平衡,氢气的平均反应速率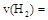 ;
;
②下列措施能使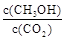 增大的是
增大的是  (填符号)。
(填符号)。
| A.升高温度 |
B.再充入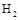 |
C.再充入 |
D.将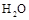 (g)从体系中分离 (g)从体系中分离 |
E.充入He(g),使体系压强增大
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=mol。
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率(填“增大”或“减小”或“不变” 下同),H2O的体积分数
(4)温度升至800℃,该反应平衡常数为0.64,则正反应为反应(填“放热”或“吸热”)。
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑,则生成物A的化学式______________
②某强酸性反应体系中,反应物和生成物共六种物质:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。
写出该反应的离子方程式:_______________________________________________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如图所示的A和B曲线,试回答下列问题: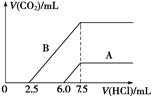
①_______曲线正确,天然碱的化学式为___________,
②加盐酸后产生CO2气体体积(标准状况)的最大值为 _____________mL。
(3) 常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态 |
| C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大 |
| D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲 |
烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: __________________
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)  2SO3(g)△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g)△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
①平衡状态由A到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为。
该反应的平衡常数为。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是。
进入21世纪,我国的几大环境污染事件中,吉林石化双苯厂发生爆炸是唯一造成国际影响的事件,近100吨含有苯、甲苯、硝基苯和苯胺(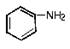 )等污染物的废水流入松花江,最终经俄罗斯入海。
)等污染物的废水流入松花江,最终经俄罗斯入海。
(1)写出上述四种污染物中含有的官能团的结构简式;
(2)苯、甲苯、硝基苯和苯胺4种物质的关系为;
| A.同系物 | B.同分异构体 | C.芳香烃 | D.芳香族化合物 |
(3)苯胺和NH3与酸反应的性质相似,写出苯胺与盐酸反应的离子方程式;
(4)①写出由苯制硝基苯的化学方程式,该反应的反应类型是;
②已知硝基苯在过量的Fe粉和盐酸的作用下可制得苯胺,写出该反应的化学方程式。