(1) 25℃时,在酸性、碱性、中性溶液中,C(H+)·C(OH-)= 。
某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)= mol/L;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中C(OH-)= mol/ L,pH= .
L,pH= .
(2) 室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液 体积的变化),测得混合溶液的pH=6,试回答以下问题:
体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L-1
(3) 室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。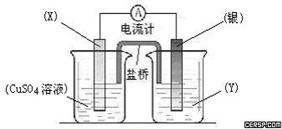
请回答下列问题:
(1)电极X的材料是;电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;
(3)外电路中的电子是从电极流向电极。
在6份0.01 mol·L-1氨水中分别加入下列各物质:
| A.浓氨水 | B.纯水 |
| C.少量K2CO3固体 | D.少量浓H2SO4 |
E.少量NaOH固体 F.少量Al2(SO4)3固体
(1)能使c(OH-)减小、c(NH4+)增大的是;
(2)能使(OH-)增大、c(NH4+)减小的是;
(3)能使c(OH-)和c(NH4+)都增大的是;
(4)能使c(OH-)和c(NH4+)都减小的是。
(1)键线式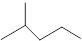 表示的分子式;名称是。
表示的分子式;名称是。
(2)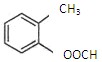 中含有的官能团的名称为。与其含有相同官能团,且分子结构中苯环上只有一个取代基的同分异构体有种。写出它们的结构简式。
中含有的官能团的名称为。与其含有相同官能团,且分子结构中苯环上只有一个取代基的同分异构体有种。写出它们的结构简式。
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
| Q |
I1 |
I2 |
I3 |
I4 |
I5 |
… |
| 电离能(kJ/mol) |
496 |
4562 |
6912 |
9543 |
13353 |
… |
回答下列有关问题:
(1)W原子的外围电子排布图为_______________________________。
(2)化合物Q2W2的电子式______________,化合物XYZ的结构式________________。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是(写分子式),原因是。
(4)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(5)Y、W、Q三种元素所形成的常见化合物的晶体类型为,YW2中的化学键类型为共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有(要求写一种即可)。
下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
|||||||||||||||
| e |
f |
||||||||||||||||
| g |
h |
||||||||||||||||
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为。
(2)在b2a2分子中,元素b为杂化,该分子是分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为,其熔点比金刚石(填“高”或“低”)。