甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) 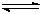 CO(g)+3H2 (g)……I CO(g)+2H2(g)
CO(g)+3H2 (g)……I CO(g)+2H2(g) 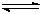 CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________ 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H ____ 0;若容器容积不变,下列措施可增加甲醇产率的是________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
④为了寻找合成甲醇的温度和压强的适宜条件,某同学设计三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
N(CO)/n(H2) |
P(Mpa) |
| i |
150 |
1/3 |
0.1 |
| ii |
|
|
5 |
| iii |
350 |
|
5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应II的特点,在给出的坐标图中,画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。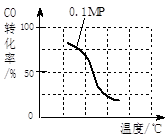
已知有如下转化关系:①C2H5OH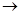 CH3CHO、②C2H4
CH3CHO、②C2H4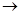 C2H5Br、
C2H5Br、
③C2H5OH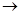 C2H4则反应①、②、③的反应类型分别为 ①、②、③。
C2H4则反应①、②、③的反应类型分别为 ①、②、③。
分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B。将A氧化最终可得B,则原有机物的结构简式为。
有下列几组物质(将正确答案字母填入空中)
| A.金刚石和石墨 |
| B.C2H6和C5H12 |
| C.C2H4和C2H6 |
| D.CH3CH2CH2CH3和CH3CH(CH3)2 |
E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是_______;属于同系物的是________;属于同位素的是________。
在25℃时,有pH=a(a≤6)的盐酸VaL和pH=b(b≥8)的NaOH溶液VbL。二者混合恰好完全中和。问:
(1)若a+b=14时,则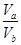 =________(填数值);
=________(填数值);
(2)若a+b=13时,则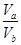 =________(填数值);
=________(填数值);
(3)若a+b>14时,则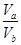 =________(填表达式),且VaVb(填“>”“<”或“=”)
=________(填表达式),且VaVb(填“>”“<”或“=”)
下列各组物质中,从某种特征分析,其中有三种物质可归为一类,请指出不能归为一类的一种物质,并说出另三种所属同一类的类别(将答案分别填写在题后的横线上)
⑴CuSO45H2O 金刚石食盐水NaOH
⑵H2O CO2 H2SO4 CaO
⑶H2SO4 Ca(OH)2 Mg Na2CO3