1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强还原剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为。
(2)写出用镁与金红石(主要成分为TiO2)在加热条件下制取钛的化学方程式:
。
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为:。
(4)镁一过氧化氢电池的工作原理如图所示,该电池放电时总反应的化
学方程式为:
硫、氯及其化合物有广泛的用途。
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质。CN-被氧化后的产物为(填化学式)。
(2)“氯胺(NH2Cl)消毒法“是在用液氯处理自来水的同时通入少量的氨气,发生反应: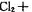
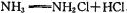 ,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是(用化学方程式表示)。
,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是(用化学方程式表示)。
(3)如图所示装置和药品可用来制备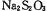 。
。
①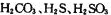 三种酸的酸性由强到弱的顺序位。
三种酸的酸性由强到弱的顺序位。
②配平广口瓶中生成 反应的化学方程式:
反应的化学方程式:
(共14分)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间生成m mol N2的同时消耗3m mol H2 |
| C.容器内的总压强不再随时间而变化 |
| D.混合气体的密度不再随时间变化 |
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
| 压强/MPa |
16.80 |
14.78 |
13.86 |
13.27 |
12.85 |
12.60 |
12.60 |
则从反应开始到25min时,以N2表示的平均反应速率=;该温度下平衡常数K=;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) ="=" NH2CO2 NH4(s)△H=" —l59.5" kJ/mol
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g)△H="+116.5" kJ/mol
CO(NH2)2(s)+H2O(g)△H="+116.5" kJ/mol
③H2O(1) ="=" H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
(Ⅰ)如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。请写出正极反应式。
(2)若开始时开关K与b连接时,两极均有气体产生,则N端是电源的极(填正或负)则总反应的离子方程式为。
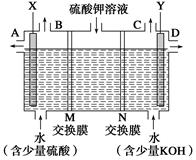
(Ⅱ)用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的_____(填“正”或“负”)极相连,氢气从_____(填“A、B、C或D”)口导出。
(2)已知离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得标准状况下5.6 L氧气,则生成氢氧化钾的质量是____________。
(共8分)
(1)2.00g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,请写出表示C2H2燃烧热的热化学方程式:;
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式:;
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式:;
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O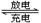 3Zn(OH)2 + 2Fe(OH)3 + 4KOH。请写出该电池在充电时阴极的电极反应式:;
3Zn(OH)2 + 2Fe(OH)3 + 4KOH。请写出该电池在充电时阴极的电极反应式:;