(8分)已知溶液中:还原性HSO3->I-,氧化性IO >I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
>I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。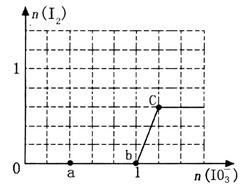
试回答下列问题:
(1)写出a点反应的离子方程式____________;反应中还原剂是_______;被还原的元素是________。
(2)写出b点到c点反应的离子方程式_______________。
(3)若往100mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2·2H2O)的流程如下:
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 |
Fe3+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
6.7 |
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的_______(填代号)。
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是____________________________。
(2)检验溶液Ⅰ中的存在Fe3+实验操作是_____________________。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因________________;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为___________;
②达到滴定终点时,仰视滴定管读数将使测定结果__________(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为__________(用含m,c,V的代数式表示,不用化简)。
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是________________。
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10 mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010mol•L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一方法是否正确?___________ (填“正确”或“不正确”),并说明理由_______________________;
(2)乙取出10mL 0.010mol•L-1氨水,用pH试纸测其pH为a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH为b,若要确认NH3·H2O是弱电解质他认为只要a、b满足什么关系?________________;
(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中abc三点对应的溶液中水的电离程度由大到小的顺序是 ___________;该醋酸溶液稀释过程中,下列各量一定变小的是____________。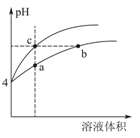
a.c(H+) b.c(OH-) c.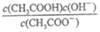 d.
d.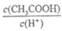
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:①该温度下水的离子积常数Kw=___________(mol/L)-2;
②在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________。
食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
| 弱酸 |
CH3COOH |
H2CO3 |
HNO2 |
| 电离常数 |
K=1.8×10-5 |
K=4.3×10-7 K=5.6×10-11 |
K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)____________;
(2)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2溶液分别与20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH )______ v(HNO2)(填“>”、“<”或“:”),原因是____________;
②充分反应后.两溶液中c(CH3COO-)______ c(NO2-)(填“>”、“<”或“=”)。
(3)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =_____;
=_____;
(4)常温下,下列方法可以使0.1mol·L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
(5)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是________。
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质 ③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
(1)25℃时,浓度为0.1 mol•L-1的6种溶液①HCl ②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_________________(填写编号)。
(2)已知25℃时,CH3COOH电离常数Ka=1.7×10-5mol/L,则:
①该温度下CH3COONa的水解平衡常数Kh=__________ mol•L-1(保留到小数点后一位);
②将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Ka=____,混合后溶液中离子的浓度由大到小的顺序为__________________。
(3)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=_________;m与n的大小关系是m___________n(填“>”“=”或“<”)。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a:X、Y是两块电极板,通过导线与直流电源相连。请回答下列问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______________,在X极附近观察到的现象是_____________。
②Y电极上的电极反应式为_______________,检测该电极反应产物的方法是_______________;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是______,电极反应式是_______________;
②Y电极的材料是______,电极反应式是_______________;(说明:杂质发生的电极反应不必写出)