(1)工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
( )Al2Te3+( ) 
( )Al( OH)3↓+( )H2Te↑
OH)3↓+( )H2Te↑
(2)在101kPa时,4.0g硫粉在氧气中完全燃烧生成SO2,放出37kJ的热量,则硫燃烧的热化学方程式为 。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
该工艺的主要流程如下。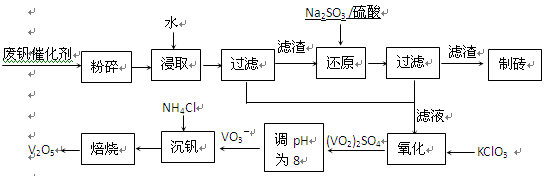
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图)。其中a、c二步的化学方程式可表示为
,。
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据上右图试建议控制氯化铵系数和温度:、。
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
(1)当乙烯气体在空气中的体积分数为16%时遇明火会发生猛烈爆炸,若爆炸时乙烯和氧气都几乎耗尽,爆炸时发生的主要反应的化学方程式是。
| A.C2H4+3O2→2CO2+2H2O | B.C2H4+O2→2C+2H2O |
| C.C2H4+2O2→2CO+2H2O | D.2C2H4+5O2→2CO2+2CO+4H2O |
E.2C2H4+3O2→2C+2CO+4H2O
(2)为测定漂白粉有效成分的质量分数,称取2.000g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+I-=3Cl-+IO3-
IO3-+5I-+3H2O6OH-+3I2
实验测得数据如下表所示:
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为。
以环戊二烯( )是一种化学活性很高的烃,存在于煤焦油中。
)是一种化学活性很高的烃,存在于煤焦油中。
(1)写出双环戊二烯的分子式;
(2)双环戊二烯的各种同分异构体当中,可能含有的官能团有;
A.碳碳双键 B.碳碳叁键 C.苯环
(3)室温下发生下列反应: 反应类型为;
反应类型为;
(4)篮烷( )是双环戊二烯的同分异构体,假设篮烷分子结构示意图中夹角只有135°、90°两种,它的一氯代物有种。
)是双环戊二烯的同分异构体,假设篮烷分子结构示意图中夹角只有135°、90°两种,它的一氯代物有种。
双酚A工业上用来生产聚碳酸酯防碎塑料,欧盟认为含双酚A奶瓶会诱发性早熟,从2011年3月2日起,禁止含生产化学物质双酚A(BPA)的婴儿奶瓶。工业上用双酚A
请回答:
(1)双酚A中含氧官能团名称为。
(2)有机物X为含氧的衍生物,其中含氧的质量分数为27.6%,经测定X的蒸气密度是同温同压下氢气的29倍,核磁共振氢氢谱中只有1种峰,则X的结构简式为。
(3)写出苯酚与X反应制取双酚A的化学方程式。
(4)若反应时双酚A跟 的物质的量之比为1:1,写出生成聚碳酸酯的化学方程式。
的物质的量之比为1:1,写出生成聚碳酸酯的化学方程式。
不粘锅之所以不粘,全在于锅底的那一层叫“特富龙”的涂料。特富龙是美国杜邦公司研发的含氟树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种含氟共聚物,PFOA(全氟辛酸铵)是生产特富龙过程中的必要添加剂。研究发现,特富龙在高温下,会释放出十几种有害气体,对健康有害。回答下列有关问题:
(1)聚四氟乙烯的合成途径如下所示:
写出由二氟一氯甲烷分解生成四氟乙烯(又称全氟乙烯)的反应方程式。
(2)聚全氟乙丙烯可看作是由四氟乙烯与全氟丙烯按物质的量比1:1通过反应(填反应类型)而得到,聚全氟乙丙烯的结构简式为。
(3)写出PFOA的化学式。