随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
该工艺的主要流程如下。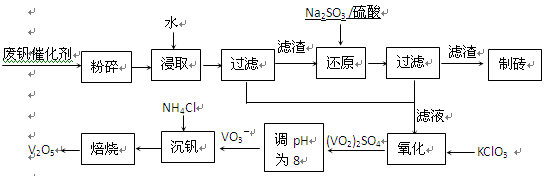
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图)。其中a、c二步的化学方程式可表示为
, 。
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据上右图试建议控制氯化铵系数和温度: 、 。
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应: 3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)= n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是_____________;写出它的氧化物与氢氧化钠反应的离子方程式____________________________________________。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程_________________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为______________________,该化合物是由___________ (填“极性”“非极性”)键形成的。
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_________,发生反应(填氧化或还原);电子从经外电路到____(填锌或铜),溶液中H+ 向移动(填正极或负极),放电一段时间后,正极区pH值(填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表,负极电极反应式为_________________,总反应的离子方程式为______。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子
可与盐酸化合生成盐,该分子的电子式是;
周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是,(填
氢化物化学式),原因是;
写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本
题涉及的含C元素的物质均易溶于水): 。
(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_____________填序号),写出反应⑥的化学方程式______。
(3)在下列化合物中:H2O2、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是,②只有极性共价键的共价化合物是,
③只含有非极性共价键的是,④既有离子键又有非极性键的化合物是。