现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)将pH=2的醋酸溶液加水稀释过程,下列表达式的数据变大的是___________。
A. c(H+) B. c(H+)/ c(CH3COOH)
C. c(H+)·c(OH-) D. c(H+)c(CH3COO--)/ c(CH3COOH-)
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)_________pH(乙)( 填“>”、“<”或“=”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K1 |
1.8×10-5 |
4.3×10-7 |
3.0×10-8 |
| K2 |
—— |
5.6×10-11 |
—— |
下列四种离子结合H+能力最强的是______________
A. HCO3- B. CO32- C. ClO- D. CH3COO-
原因是___________________________________
(9分)
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。

| 实验方案(I) |
实验现象(Ⅱ) |
答案(III) |
|
| 实验方案I |
实验现象II |
||
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 水反应,再向反应液中滴 加酚酞 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 动,随之消失,溶液变红色。 |
1 |
|
2.向新制的H2S饱和溶 液中滴加新制的氯水 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 烧,溶液变成浅红色 |
2 |
|
3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体 可以在空气中燃烧 可以在空气中燃烧 |
3 |
|
4.镁带与2mol/L的盐酸 反应 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 空气中燃烧 |
4 |
|
5铝条与2mol/L的盐酸 反应 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 消失 |
5 |
|
6.向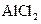 溶液中滴加 溶液中滴加 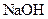 溶液至过量 溶液至过量 |
F.生成淡黄色沉淀 |
6 |
(2)通过以上实验分析了同周期元素的符号,从实验结果可以得出的结论是。
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: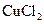 溶液、
溶液、 溶液、盐酸。按要求回答下列问题:
溶液、盐酸。按要求回答下列问题:
 (1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
 (2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池 ,若能,请写出电极反应式,负极,正极。(若不能,后两空不填)
,若能,请写出电极反应式,负极,正极。(若不能,后两空不填)
 (3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池
(3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池 的正负。)
的正负。)
下列五种物质中,①Ar②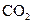 ③
③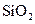 ⑤
⑤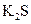 ,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
下列反应中属于取代反应的是,属于加成反应的是。
①甲烷在光照下与氯气反应 ②乙烯使溴水褪色③乙烯使酸性高锰酸钾溶液褪色 ④苯与液溴反应 ⑤乙醇与乙酸酯化 ⑥苯与浓硝酸和浓硫酸的混酸反应
下面列出了几组物质,请将物质的合适序号填写在空格上。
互为同位素的是,互为同系物的是,互为同分异构体的是。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O;
④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
|
CH3
⑦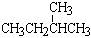 和 CH3-C-CH3
和 CH3-C-CH3
|