工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)  Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ |
C.反应至4min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03mol/(L·min mol·L-1,则H2的反应速率为0.03mol/(L·min |
| D.当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应 |
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是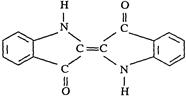
| A.靛蓝由碳、氢、氧、氮四种元素组成 |
| B.它的分子式是C16H10N2O2 |
| C.该物质是高分子化合物 |
| D.它是不饱和的有机物 |
1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A.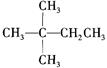 |
B.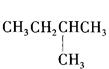 |
| C.CH3CH2CH2CH2CH3 | D. CH3- |
对于烃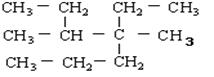 ,的命名正确的是:
,的命名正确的是:
| A.4—甲基—4,5—二乙基己烷 | B.3—甲基—2,3—二乙基己烷 |
| C.4,5— 二甲基—4—乙基庚烷 | D.3,4— 二甲基—4—乙基庚烷 |
0.2mol某烷烃完全燃烧后,生成的气体缓缓通过盛有0.5L 2mol / LNaOH溶液中,生成的 Na2CO3和NaHCO3的物质的量之比为1:3,则该烷烃为
| A.甲烷 | B.乙烷 | C.丙烷 | D.丁烷 |
某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是
| A.CH3CH2OCH3 | B.CH3CH(OH)CH3 |
| C.HCOOCH33 | D.CH3CH2CHO |