草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 ▲ 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: ▲ 。
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: ▲ 、 ▲ ;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃.
的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸
亚铁锂的化学方程式为: ▲ 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,
写出相应的电极反应式:
正极 ▲ 、负极 ▲ 。
用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| Ⅰ |
x≥a |
电极附近出现黄色,有气泡产生 |
有Fe3+、有Cl2 |
| Ⅱ |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有Fe3+、无Cl2 |
| Ⅲ |
b>x>0 |
无明显变化 |
无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_____________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:
__________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| Ⅳ |
a>x≥c |
无明显变化 |
有Cl2 |
| Ⅴ |
c>x≥b |
无明显变化 |
无Cl2 |
①NaCl溶液的浓度是________mol·L-1。
②Ⅳ中检测Cl2的实验方法_________________________。
③与Ⅱ对比,得出的结论(写出两点):。
I.氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
(1)反应开始时反应速率加快的原因是___________________。
(2)反应后期反应速率下降的原因是___________________。
II.用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
(1)下列说法正确的是______(填序号)。
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产生 |
| B.a电极上发生的反应为2H++2e-===H2↑和4OH--4e-===2H2O+O2↑ |
| C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1 |
| D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化 |
(2)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的c(H+)= ______。(3)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为______mol。
(4)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料。
已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1
②CH4(g)+ O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH2=-36 kJ·mol-1
③CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=+216 kJ·mol-1
(1)氢气的燃烧热为________,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: ________________。
(2)现有1 mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应。当x=________时,反应②与③放出(或吸收)的总能量为0。若②反应过程中能量转化过程如图所示,下列有关说法中正确的是________。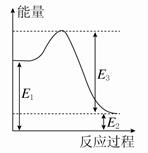
| A.E1=36 kJ | B.E2=36 kJ |
| C.E1-E2=36 kJ | D.E3-E1=36 kJ |
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g) ΔH1(CO结构式为C≡O)。又知某些化学键的键能(断开1 mol化学键时所需要的最低能量)数值如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能 (kJ·mol-1) |
348 |
413 |
436 |
358 |
1072 |
463 |
则ΔH1=_______,在相应的反应条件下,将1 mol CO(g)与足量H2混合充分反应后,放出或吸收的热量△H1。(用>,<或=填空)
I.A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式:________。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式 。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是________________。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是________________。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3 气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为_____________。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式 ___________;若0.1 mol该化合物完全反应,转移电子的物质的量为________。
II.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为________。
A、B、D、E是周期表中前20号元素,它们的原子序数依次增大。EA2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)写出元素符号:A、B。
(2)镁条在AB2中燃烧的化学方程式为____________________。
(3)将D单质放入浓HNO3中加热,生成红棕色气体和一种强酸,该反应的离子方程式为。
(4)A可形成二元弱酸H2A2O4,0.1 molH2A2O4与100 mL 2 mol/L的KOH溶液反应后,溶液中的离子浓度由大到小的排列顺序是_______________。