某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)发生氧化反应的烧杯是________(填“甲”或“乙”).
(2)外电路的电流方向为:从________到________.(填“a”或“b”)
(3)电池工作时,盐桥中的SO移向________(填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为______________________________________________.
(8分)掌握物质之间的转化,是学习元素化合物知识的基础。
(1)中学常见的某有色物质,全部由短周期元素组成,能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。试写出符合条件的两种不同类别的物质(写化学式)_________ _、____________。
(2)中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。若 C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式___________________;
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________________,装置d中所盛溶液是____________________。
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤①中用硫酸酸化的目的是__.步骤②发生反应的离子方程式为。
(2)步骤④利用了SO2的还原性,反应的离子方程式:__________________________.
(3)步骤⑥的名称是 ____________。
(4)从含溴水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是:3Na2CO3+3Br2= NaBrO3+ 5NaBr+ 3CO2;吸收1mol Br2时,转移的电子数为mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将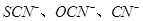 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性 溶液中,溶液立即变成血红色;通入
溶液中,溶液立即变成血红色;通入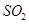 后,血红色消失。血红色消失过程中发生反应的离子方程式为。
后,血红色消失。血红色消失过程中发生反应的离子方程式为。
铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+1、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,该反应中是元素被还原 。
2Cu+SO2反应制取粗铜,该反应中是元素被还原 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为:温度控制在50℃-60℃的原因除了加快反应速率外,还有。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式。
(3)现向Cu、Cu2O和CuO组成的混合物中,加入2 L 0.6 mol·L-1 HNO3溶液恰好使混合物溶解,同时收集到4480 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式。若将上述混合物用足量的H2加热还原,所得到固体的质量为g。若混合物中含0.2 mol Cu,将该混合物与稀硫酸充分反应,消耗H2SO4的物质的量为mol。
铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol·L-1FeC13溶液,至液体呈透明的红褐色,该反应的离子方程式为,形成该分散系的微粒粒度范围是。
(3)电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出 FeC13溶液与铜反应的离子方程式。欲从腐蚀后的废液中回收铜并重新获得FeC13溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水,需要用到的一组试剂是
A.①②④B.①③④⑥C.②④⑤D.①④⑥
(4)高铁酸钠Na2FeO4是一种新型净水剂。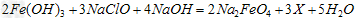 ①高铁酸钠主要通过如下反应制取:
①高铁酸钠主要通过如下反应制取:
则X的化学式为_______ ______。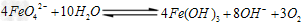 ②高铁酸钠在水中可以发生如下反应:
②高铁酸钠在水中可以发生如下反应:
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。
③ 下列物质能作净水剂的有。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
水是生命之源,也是化学反应的主角。试回答下列问题:
A、B、C是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
(1)A +H2O:__________________;(2)B+H2O:_________________;(3)C +H2O:______________。