下表是元素周期表的一部分。
已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):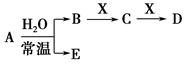
(1)⑧的元素符号是________。
(2)⑤与As两种元素中,非金属性较强的是________(填元素符号)。
(3)若E为氧化物,则A、X的化学式分别为________、________。
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的碱性溶液反应,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子。该反应的离子方程式为______________________。
某种医药中间体G,常用来制备抗凝血药,其结构简式是: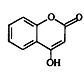 。
。
(1)G中含氧官能团是。
(2)下列关于G的说法正确的是。
a.能与溴单质反应b.能与金属钠反应
c.1 molG最多能和3 mol氢气反应 d.分子式是C9H7O3
可通过下列路线合成此医药中间体:
请回答下列问题:
(3)A与银氨溶液反应有银镜生成,则A的结构简式是;B→C的反应类型是 。
。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
。
(5)E的结构简式是;与D互为同分异构体且含苯环、属于酯类的有机物有种。
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是(用元素符号表示)
(2)A、B、C为同一短周期金属元素。依据下表数据分析,C元素在化合物中的主要化合价为;第二电离能(I2)B小于A的原因是。
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
500 |
4600 |
6900 |
9500 |
| B |
740 |
1500 |
7700 |
10500 |
| C |
580 |
1800 |
2700 |
11600 |
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是。
(4)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+  R(OH)3
R(OH)3  [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为。
②[R(OH)4]-中存在的化学键是。
A.离子键 B.极性键 C.非极性键D.配位键
C.非极性键D.配位键
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下: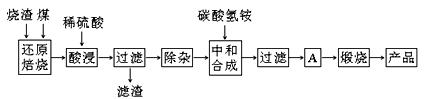
(1)在“还原焙烧”中产生的有毒气体可能有。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:。
(3)根据下表数据:
| 氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
| 完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于,当pH=5时,溶液中c(Al3+)为mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是。
(5)A的操作是。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含m、n的表达式表示)。
甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。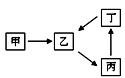
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是 ;
;
②丙溶液中通入少量CO2生成丁的离子方程式是。
(2)若2乙(g) + 甲(g)  2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
| 温度/℃ |
400 |
450 |
500 |
550 |
600 |
650 |
| 转化率/% |
99.2 |
97.5 |
93.5 |
85.6 |
73.7 |
58.5 |
①该反应的△H0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是;
②已知:R(s) +  O2(g) =
O2(g) =  R2O3(s) △H=-834.8 kJ·mol-1
R2O3(s) △H=-834.8 kJ·mol-1
Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol-1
写出R的单质与MnO2反应的热化学方程式。
食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是 ▲。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol•L-1,则该食醋的总酸量为4.5/100mL
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法 验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 ▲(填写序号)。
验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 ▲(填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1HCl溶液和20.00mL0.1000 mol•L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。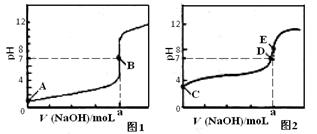
滴定醋酸溶液的曲线是 ▲(填“图l”或“图2”);滴定曲线中a= ▲mL。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是 ▲。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸