(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是 (用元素符号表示)
(2)A、B、C为同一短周期金属元素。依据下表数据分析,C元素在化合物中的主要化合价为 ;第二电离能(I2)B小于A的原因是 。
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
500 |
4600 |
6900 |
9500 |
| B |
740 |
1500 |
7700 |
10500 |
| C |
580 |
1800 |
2700 |
11600 |
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取 杂化;通常情况下,H2O2与水任意比互溶的主要原因是 。
(4)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+  R(OH)3
R(OH)3  [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为 。
②[R(OH)4]-中存在的化学键是 。
A.离子键 B.极性键 C.非极性键 D.配位键
C.非极性键 D.配位键
根据已学知识,请你回答下列问题:
(1)元素的原子最外层电子排布式为nsnnpn+1,该元素的名称为______________;
(2)C、N、O、F电负性由大到小的顺序是 ;
(3)铜基态核外电子排布式是________ _;
(4)钛的基态M能层电子排布图 ;
(5)C、N、O、F第一电离能由大到小的顺序是 ;
(6)铬元素在周期表中位于__________区;
(7)一至四周期中,未成对电子数和能层数相等的元素有 种;
(8)仅由第二周期元素组成的共价分子中,互为等电子体的是CO2和_________;N2和________。
(9)CH2=CH2中碳原子采取 杂化;
(10)水分子的空间构型为 。
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)则95℃时水的电离平衡曲线应为 (填“A”或“B”)。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)95℃时,若1体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是(用含a、b的等式表示):
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________, K值大小与温度的关系是:温度升高,K值______________。(填一定增大、一定减小、或可能增大也可能减小);
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。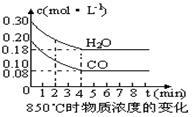
(3)该反应的化学平衡常数表达式为K= _,850℃时当反应进行到4min时即达到平衡状态,这时化学平衡常数的数值为 。
依据事实,写出下列反应的热化学方程式.
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O. 放出571.6kJ的热量,表示H2燃烧的热化学方程式为__________
(2)在25℃、101kPa下,1g甲醇(CH3OH)液体燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为______ _
(3)已知:已知:C(s)+O2(g)=CO2(g)△H=﹣437.3kJ•mol一1
H2(g)+ O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是_____ ____
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。