本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键  D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下: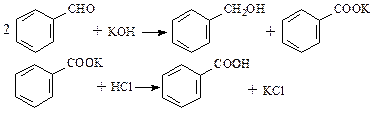
有关物质的部分物理性质如下:
| |
熔点/℃ |
沸点/℃ |
溶解性 |
| 苯甲醛 |
—26 |
179 |
微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 |
122 |
249 |
微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 |
-15.3 |
205.0 |
稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 |
-116.2 |
34.5 |
微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
① P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
② P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为。
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物。
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为单质气体,D为白色沉淀,A的化学式可能是, C与X反应的离子方程式为。
(2)若E为氧化物,则A与水反应的化学方程式为。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为,表示X呈碱性的离子方程式为。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为。
(8分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
Cl-、SO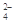 、NO3-、OH- 、NO3-、OH- |
现进行以下实验:
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出电解质的化学式:甲乙
(2)丙物质中的化学键有,丁的阳离子的结构示意图是;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合:
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O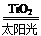 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O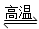 CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列说法正确的是_____。
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(9分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。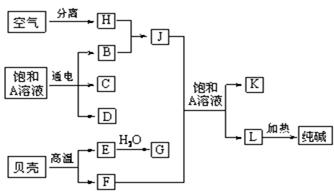
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式:。
(2) 电解A溶液反应的离子方程式为___________________________。
若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为L
(3) J分子的空间构型为______________________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:_______________________________________。