(14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(2)某同学根据上述信息,所画的B电子排布图如图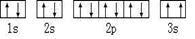 ,违背了 原理。
,违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握一项基本技能。请按照要求完成下列方程式。
Ⅰ.生活中很多现象和原理都可以用化学反应来解释:写出 泡沫灭火器反应原理 的离子方程式:________________________________________________________________________
Ⅱ.某一反应体系有反应物和生成物共六种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。写出该反应的化学方程式:______________________________________________
Ⅲ.有一些反应,表面上似乎违背了反应的基本原理,事实上他们是完全符合反应基本原理的。请完成下列反应:
① 写出 两种弱酸溶液混合反应后,溶液的酸性减弱 的化学方程式
________________________________________________________________________
② 写出 一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸 的离子反应方程式
________________________________________________________________________
某研究性学习小组为合成1 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线:
CH3CH CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)写出实验室制备氢气的化学方程式:。
(2)若用以上装置制备干燥纯净的CO,装置中b的作用分别是; C中盛装的试剂是。若用以上装置制备H2,在虚线框内画出收集H2干燥的装置图。
(3)制丙烯时,还产生少量SO2, CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①足量饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液
(4)下图所示装置工作时均与H2有关。
①图1所示装置中阳极的电极反应式为。
②图2所示装置中,通入H2的管口是(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论(填“严密”或“不严密”),你的理由是(用离子方程式表示)。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)  2SO3(g)∆H="-196.6" kJ·mol-1
2SO3(g)∆H="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ∆H="-113.0" kJ·mol-1
2NO2(g) ∆H="-113.0" kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的∆H= kJ·mol-1。
SO3(g)+NO(g)的∆H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
A.每消耗1 mol SO3的同时生成1 mol NO2B. 体系压强保持不变
C.混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)

(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应∆H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应∆H 0(填“>”或“ <”)。
已知A~F是中学化学常见的物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E。反应中部分生成物已略去。试回答下列问题:
(1)写出B的电子式 ,化学键类型。
(2)根据图中信息,B、C、X氧化性从强到弱的顺序是________________________。
(3)X与铝高温下反应的方程式为______________。
(4)写出反应②的化学方程式_____________。
(5)反应①的离子方程式。
①现有下列物质:①盐酸②纯碱③豆浆④烧碱⑤干冰⑥食盐水⑦氢气⑧泥水。
请根据它们所属的类别选择相应的序号填入下表中。
| 类别 |
单质 |
酸 |
碱 |
盐 |
氧化物 |
胶体 |
| 物质 |