有三个氧化还原反应:①2FeCl3+2KI===2FeCl2+I2+2KCl
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
下列说法正确的是
A.下图所示的是一个放热反应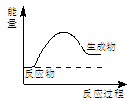 |
| B.加入催化剂v(正)增大、v(逆)减小 |
| C.吸热反应只能在加热的条件下才能进行 |
| D.只有活化分子才能发生有效碰撞 |
在容积固定不变的密闭容器中,可逆反应:A2(g)+B2(g) nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
| A.Y轴表示A2的转化率 | B.Y轴表示C的浓度 |
| C.Y轴表示混合气体的密度 | D.Y轴表示混合气体的平均摩尔质量 |
Li-A1/FeS电池是一种正在开发的车载电池,该电池中正极为Al/FeS复合材料,且电极反应式为:2Li++FeS+2e-=Li2S+Fe有关该电池的下列叙述中正确的是( )
| A.该电池的总反应式为:2Li+FeS=Li2S+Fe |
| B.Li—Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| C.负极的电极反应式为Al-3e-=Al3+ |
| D.充电时,阴极的电极反应式为:Li2S+Fe-2e-==2Li++FeS |
关于下列装置说法正确的是( )
| A.装置①中,溶液中的SO42-移向Cu电极 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn沿导线流向Fe,溶液中有Fe2+生成 |
常温下,下列叙述正确的是( )
| A.某醋酸溶液的pH=a,若将此溶液稀释l0倍后溶液的pH=b,则a>b |
| B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D.若lmL pH=1的盐酸与l00mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |