A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)_________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)__ __ > > 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为: 。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为 ;此时该反应的平衡常数K= 。
(4)有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl一NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③100 mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50
mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50 mL烧杯;应选用的仪器有(填编号)。
mL烧杯;应选用的仪器有(填编号)。
(2)应称取Na2CO3的质量为。
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①取25mL甲溶液, 向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体。
向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体。
②取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到56mL(标准状况)气体。
(1)判断:甲是溶液,乙是溶液;(均填化 学式)
学式)
(2)②实验中所发生反应的离子方程式为:
;
(3)甲溶液的物质的量浓度为mol/L,乙溶液的物质的量浓度为mol/L
现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。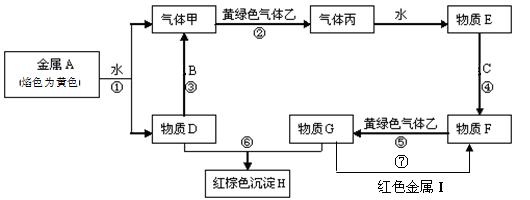
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C、H
(2)写出反应①的离子方程式:。
写出反应⑦的离子方程式:。
(3)实验室检验物质G中阳离子的常用试剂是:。
SO3和SiO2均属于酸性氧化物,能溶于水的是_________,反应的化学方程式是___________________________;SiO2与氢氟酸(HF的水溶液)反应,常用于刻蚀玻璃,该反应的化学方程式是_________________________________。请写出Al2O3分别与盐酸、氢氧化钠溶液反应的离子方程式:____________________________,___________________________________,所以Al2O3属于______氧化物。
(1)白色的Fe(OH)2在空气中发生的颜色变化为________________________;
(2)写出硅酸钠溶液在空气中变质的化学方程式:____________________________;
(3)写出用熟石灰吸收氯气制漂白粉的化学方程式:;
(4)将CaMg3Si4O12改写为氧化物的形式:__________________________________。