已知有机物A分子由C、H、O三种元素组成,其相对分子质量为120,0.1 molA在足量的氧气中充分燃烧后生成0.8mol CO2 和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
molA在足量的氧气中充分燃烧后生成0.8mol CO2 和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
(1)A的分子式是 ,A中含氧官能团的名称是 ,A的结构简式为 。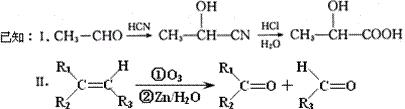
现有如下转化关系: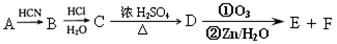
其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
(2)C可能具有的化学性质有 (填序号)。
①能与H2发生加成反应;②能在碱性溶液中发生水解反应;③能与甲酸发生酯化反应;④能与Ag(NH3) 2OH溶液发生银镜反应;⑤能与氢氧化钠溶液反应
(A)①②③ (B)①③⑤ (C)①②③⑤ (D)②③④⑤
(3)①写出C→D的化学反应方程式 ;反应类型为 ;
②在催化剂条件下,C生成高聚物的化学方程式 ;
③ G与足量NaHCO3溶液反应的化学方程式 。
(4)C的同分异构体有 多种,其中符合下列要求的有机物有两种:
多种,其中符合下列要求的有机物有两种:
①属于酯类化合物;②遇三氯化铁溶液显紫色;③与新制氢氧化铜悬浊液共热可生成红色沉淀;④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式 。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
质量分 数(%) 数(%) |
12 |
24 |
12 |
1 6 6 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物
写出反应②和③的化学方程式, 。
(2)试管B收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,其一氯代物有_____________种。
(3)锥形瓶C中观察到的现象 。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为__________________。
。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为__________________。
(4)写出C中逸出的气体在工业上的两种用途__________________、__________________。
有机玻璃是一种重要的塑料,有机玻璃的单体A(C5H8O2)不溶于水,并可以发生以下变化,请回答: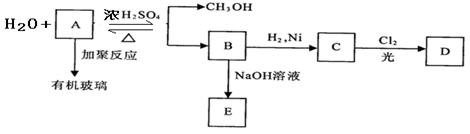
(1) B分子中含有的官能团名称是_____________, _____________。
(2) 由B转化为C的反应属于(选填序号) _____________。
① 氧化反应② 还原反应③ 加成反应 ④ 取代反应
④ 取代反应
(3) C的一氯代物D有两种,C的结构简式是_____________。
(4) 由A生成B的化学方程式是___________________________ ________________。
________________。
(5) 有机玻璃的结构简式是____________________________________。
在一定温度下,将2mol A和2mol B两种气体相混合于体积为
2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) x C(g)+2D(g)
x C(g)+2D(g)  H <0, 2min末反应达到平衡状态(温度不变),生成了0
H <0, 2min末反应达到平衡状态(温度不变),生成了0 .8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于。
(2)计算该反应的化学平衡常数K=,升高温度时K值
将(选填“增大”、“减小”、“不变”)。
(3)A的物质的转化率为。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为mol;达新平衡时,A的物质的量为n(A)= mol。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为____________,
在X极附近观察到的现象是 :______________________;
Y电极上的电极反应式是_________________________,
检验该电极反应产 物的方法是:_______________________________。
物的方法是:_______________________________。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,电极反应式是________________________。
(15分)
分别由C、H、O三种元素组成的有机物A、B、C互为同分异构体,它们分子中C、H、O元素的质量比为15︰2︰8,其中化合物A的质谱图如下。
A是直链结构,其核磁共振氢谱有三组峰,且峰面积之比为1︰1︰2,它能够发生银镜反应。B为五元环酯。C的红外光谱表明其分子中 存在甲基。其它物质的转化关系如下:
存在甲基。其它物质的转化关系如下:
⑴A的分子式是:。A分 子中的官能团名称是:。
子中的官能团名称是:。
⑵B和G的结构简式分别是:、。
⑶写出下列反应方程式(有机物用结构简式表示)
D→C;
H→G。
⑷写出由单体F分别发生加聚反应生成的产物和发生缩聚反应生成的产物的结构简式:、。