下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑥ |
|
⑦ |
|
|
| 3 |
① |
③ |
⑤ |
|
⑧ |
|
⑨ |
⑩ |
| 4 |
② |
④ |
|
|
|
|
|
|
(1)10种元素中,化学性质最不活泼的是___________;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是__________;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为___________;该氢化物常温下和元素①的单质反应的化学方程式_____________________________;
(4)元素⑧的最高价氧化物对应水化物的化学式为________;元素⑨的最高正化合价为__________,氢化物的化学式为_____________;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为________________。
酸牛奶是人们喜爱的一种营养饮料.酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖.酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用.工业上乳酸可由乙烯来合成,方法如下: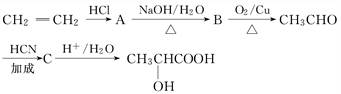
(1)乳酸所含的官能团的名称是_________________________________________.
(2)乳酸自身在不同条件下可形成不同的酯,其酯的相对分子质量由小到大的结构简式依次为:__________________、__________________、__________________.
(3)写出下列转化的化学方程式:
A的生成________________________________________________________.
CH3CHO的生成______________________________________________________,
C的生成____________________________________________________________.
A→B的反应类型为___________________________________________________.
医药化学杂志报道,用聚乙交酯纤维材料C制作的缝合线比天然高分子材料的肠衣线的性能好.它的合成过程如下:
(1)写出A的结构简式______________________________________________.
(2)写出A制取B的化学方程式_______________________________________.
(3)可以由A直接制备C,则由A直接制备C的化学方程式为_____________.其反应类型为________________.
高分子化合物A和B的部分结构如下: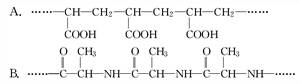
(1)合成高分子化合物A的单体是________,生成A的反应是________反应.
(2)合成高分子化合物B的单体是________,生成B的反应是________反应.
完成下列反应的化学方程式,并指出反应类型.
(1)由乙烯制取聚乙烯:
________________________________________________________________________,
(2)由丙烯制取聚丙烯:
________________________________________________________________________,
(3)由对苯二甲酸(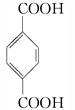 )与乙二醇发生反应生成高分子化合物:
)与乙二醇发生反应生成高分子化合物:
______________________________________,________________________.
聚苯乙烯的结构为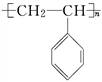 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是________________________,单体是______________________.
(2)实验测得某聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________________.