已知:①有机物X的相对分子质量小于180,其中氧的质量分数约为49.4%,②1 mol X在稀硫酸中发生水解反应生成2 mol 甲醇和1 mol A,③X中没有支链.④有机物X、A物质能发生如下图转化关系,E为高分子的化合物,B为环状结构.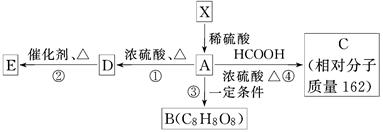
根据以上信息填写下列空白:
(1)1个X分子中,含有________个氧原子,X不可能发生的反应有________(填序号)
①加成反应 ②酯化反应 ③氧化反应 ④消去反应
(2)A分子中的官能团是(写名称)________,A的摩尔质量是________.
(3)写出④的化学方程式____________________________________________.
(4)有机物“C8H8O8”因分子组成中含有三个国人心目中的吉利数字“8”而被称为“吉利分子”.由A转化而生成的“吉利分子”有多种不同的环状结构,写出其中的含一个六元环的有机物B结构简式________________.
(5)一定量的A物质与乙醇的混合物完全燃烧生成27 g水和V L CO2(标准状况),则等物质的量该混合物完全燃烧消耗O2的物质的量为________.
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g)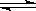 3C(g),已知加入1molA和3molB且达到平衡后生成了a mol C,请填写下列空白:
3C(g),已知加入1molA和3molB且达到平衡后生成了a mol C,请填写下列空白:
(1)平衡时C在混合气体中的体积分数是______________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,C的物质的量为______ mol(用字母a表示)。此时C在反应混合气体中的体积分数______(填“增大”、“减少”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气体中的体积分数不变,则还应加入C___ mol。
(4)在同一容器中加入n mol A和3n mol B,达到平衡时C的物质的量为m mol,若改变实验条件,可以使C的物质的量在m mol~2m mol之间变化,那么n与m的关系应是____________(用字母“m”“n”表示)。
工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g)
CO2 (g) + H2(g)
△H=Q kJ/mol,已知该反应的平衡常数K与温度T的关系下图所示。若在一固定的密闭容器中, 850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表: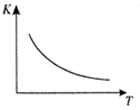

已知:850℃ 时该反应的化学平衡常数K =" 1.0" ,请回答下列问题:
(1) Q 0(填“ > ”、“ = ”或“<” )。
(2)若在850℃时向反应容器中充人H2O(g),K 值(填增大、减小、不变)
(3)上表中 c2为mol/L , CO(g)的转化率为(保留三位有效数字)
某100 mL物质的量浓度为1 mol/L的NaOH溶液。试计算:
(1) 该溶液中NaOH的质量。
(2) 上述溶液与物质的量浓度为1 mol/L 的HCl溶液恰好完全反应,需HCl溶液的体积是多少毫升?
(3) 该反应后得到溶液中溶质的物质的量是mol。
实验室需要0.1 mol/L的硫酸920 mL,某同学欲用密度为1.84 g/cm3、溶质的质量分数为98%的浓硫酸进行配制。试回答:
(1)需选用_________容量瓶(填序号)。
A.50 mL B.100 mL C.250 mL D.1000 mL
(2)需量取98%浓硫酸的体积为__________mL。
(3)下列关于容量瓶的使用方法中,正确的是________(填序号)。
A.使用前要检验是否漏水
B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中
D.向容量瓶中转移溶液时,用玻璃棒引流
(4)导致浓度偏低的原因可能是________(填序号)。
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过硫酸溶液,使用前未洗涤
D.定容时俯视刻度线和液面
E.未洗涤烧杯、玻璃棒
草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl)。某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤.取滤液;③蒸发滤液;④冷却结晶。为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等分:
①取一份溶液,加入适量HCl,观察到____________________________,证明含有碳酸根。
②取另一份溶液,为检验SO42-,应往溶液中先加入过量的_______,再加入BaCl2溶液。
③取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl-。你认为所得的结论是否严密?______。理由是。