(16分)Ⅰ铝粉与某些金属氧化物组成的混合物叫铝热 剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+
剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+ Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上
Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上 述信息回答下列问题:
述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的________________反应。
(2)信息中的“某些”指__(填“比铝活泼的”“比铝不活泼的”或“任意”)。
(3)试写出铝粉与MnO2发生的铝热反应方程式
_____________________________________________________________。
(4)题给的铝热反应可用于野外焊接钢轨,试解释其基本原理________________________________________________________________。
II铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(5)铝制容器不能盛装NaOH溶液的原因(用离子方程式表示)
; (6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
(6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式:
;
(7)为完全沉淀氯化铝溶液中的铝元素,常加入过量的 ,反应的化学方程式: 。
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,你认为原因是;
(2)4~5 min时间段的反应速率最小,你认为原因是; (3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=;
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=;
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
| A.H2O | B.NaCl溶液 | C.Na2CO3溶液 | D.Cu粉E.CuSO4粉末; |
你认为可行的是(填编号)。
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。
请回答下列问题: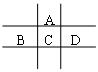
(1)B元素在周期表中的位置为;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是,最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示)。
有下列一组物质:He、Cl2、CH4、Na2O2、Ba(OH)2、NO2、KNO3、H2SO4,请从中选择,用化学式填写下列空白:
(1)只含有共价键,不含其他化学键的化合物有;
(2)既含有共价键又含有离子键的物质有;
(3)能在水中发生氧化还原反应的有。
某微粒的结构示意图为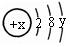 试回答:
试回答:
(1)当x-y=10时,该粒子为(选填“原子”或“阳离子”、“阴离子”);
(2)当y=8时,该粒子可能是(用化学式表示,任填3种)、、;
(3)请写出工业上制取y=7元素对应单质时的离子方程式:
。
冶炼金属常用以下几种方法:①以C、CO或H2做还原剂②以活泼金属Na、Mg等还原③利用铝热反应原理还原④电解法⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)(共10分)
(1)Fe、Zn、Cu等中等活泼金属。
(2)Na、Mg、Al等活泼或较活泼金属。
(3)Hg、Ag等不活泼金属。
(4)V、Cr、Mn、W等高熔点金属。
(5)K、Rb、Cs、Ti等金属通常还原方法是。