某溶液中可能含有大量下列阴离子:OH-、SO、CO、Cl-。
(1)当溶液中存在大量H+时,则溶液中不可能有________________。
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有________________。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
CO (g)+2H2 (g) CH3OH (g)
CH3OH (g)
(1)在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入 催化剂后在250 ℃开始反应,
CO的平衡转化率与温度、压强的关系如图所示。容器中M、N两点气体的物质的量之比为。M、N、Q三点的平衡常数KM、KN、KQ的大小关系为。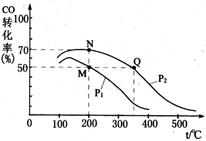
(2)通过压力计监测上述容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/Mpa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率为,该温度下平衡常数K=。
(3)下列描述中能说明上述反应已达平衡状态的是。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300 mL NaCl溶液,正极反应式为。在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为__________。
【化学一一选修物质结构与性质】(15分)有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物, D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题。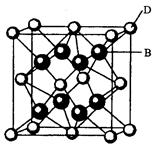
(1)E元素原子基态时的价电子排布式为;
(2)A2F分子中F原子的杂化类型是_____;
(3)C元素与氧形成的离子CO2-的立体构型是__________;写出一种与CO2-互为等电子体的分子的分子式________;
(4)将E单质的粉末加入CA3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是______________________________________________________;
(5)从图中可以看出,D跟B形成的离子化合物的化学式为;若离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(写出表达式即可)。
(16分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)∆H=kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H0,(填“>”或“<”)。
若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将(填“增大”、“减小”或“不变”)。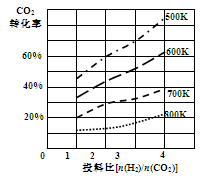
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)=。[已知:Ksp(CaCO3)=2.8×10-9]
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象;当燃料电池消耗2.8 L O2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出)。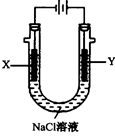
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。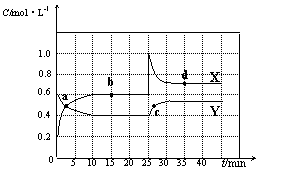
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是;a、b、c、d四个点中,表示化学反应处于平衡状态的点是。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=mol·L-1·min-1。
②反应2NO2(g) 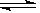 N2O4(g)在b点的平衡常数K(b)=。
N2O4(g)在b点的平衡常数K(b)=。
③反应2NO2(g) 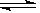 N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d)K(b)(填“>”、“=”或“<”)。
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d)K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是(填序号)。
| A.加入催化剂 | B.缩小容器体积 |
| C.加入一定量的NO2 | D.加入一定量的N2O4 |
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是。
(1)某温度下,纯水中的c(H+)=3×10-7 mol/L,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=__,由水电离出的c(H+)为_____。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是 ______;(填序号)
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②、③混合(填“>”、“<”或“=”);
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③________④ (填“>”、“<”或“=”);
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精⑨氯水 ⑩H2SO4
a.上述物质中可导电的是(填序号,以下同);
b.上述物质中属于非电解质的是。