在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去)。图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15 m L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
(1)③试管中制取次氯酸钠的化学方程式为
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格。
| 实验现象 |
原因 |
| 溶液最初从紫色变为 色 |
氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 |
|
| 最后溶液从无色逐渐变为 色 |
|
(3)此实验有一个明显的不足之处,应如何改进? 
实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
试剂:①镁条②铝条③AlCl3溶液④MgCl2溶液
⑤NaOH溶液⑥氯水⑦溴水⑧NaBr溶液
| 实验方案 (只填写选用试剂序号) |
实验现象 |
结论 |
|
| ⑴ |
一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 |
金属性: |
|
| ⑵ |
非金属性:Cl>Br |
写出实验(2)中所发生的离子反应方程式
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。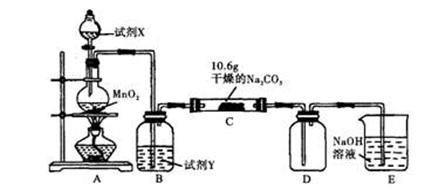
(1)写出装置A中发生反应的化学方程式:
。
(2)写出试剂Y的名称:。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含氯元素的盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和;
假设2:存在三种成分:NaHCO3和、。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3:向B试管中滴加过量的稀HNO3溶液,再滴加AgNO3溶液。 |
若溶液变浑浊,结合步骤2中①,则假设1成立,结合步骤2中②,则假设2成立。 |
(4)已知C中有0.1mol Cl2参加反应。若假设l成立,可推知C中反应的化学方程式为:。
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解。
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是(填实验序号),
⑵步骤②中洗涤沉淀的操作是 。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,实验时均以生成25 mLO2为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
| ④ |
1.2 g |
无其他物质 |
|
| ⑤ |
1.2 g |
CuO 0.5 g |
|
| ⑥ |
1.2 g |
MnO2 0.5 g |
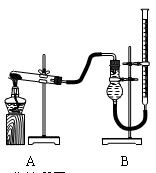
回答下列问题:
⑶上述实验中的“待测数据”是指。
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是(填“酸式”或“碱式”)滴定管。
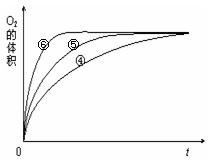
⑸实验④、⑤、⑥中,测得生成氧气的体积随时间变化的关系如右图,分析右图能够得出的实验结论是。
照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(已知:4H++2[Ag(S2O3)2]3- =Ag2S↓+3S↓+3SO2↑+ SO42-+ 2H2O;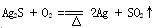 ;
; 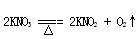
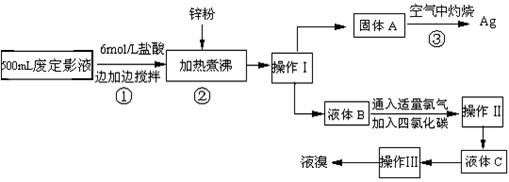
⑴操作Ⅰ的名称是;操作Ⅱ需要的主要玻璃仪器有。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为。
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 |
色态 |
挥发性 |
熔点 |
沸点 |
| 金黄色液体 |
易挥发 |
-76℃ |
138℃ |
|
| 化学性质 |
300 ℃以上完全分解 |
|||
S2Cl2+Cl2 2SCl2 2SCl2 |
||||
| 遇水反应生成SO2、S等产物 |
向熔融的硫中通以干燥、纯净的C12即可生成S2C12。下图是实验室制备S2Cl2的装置。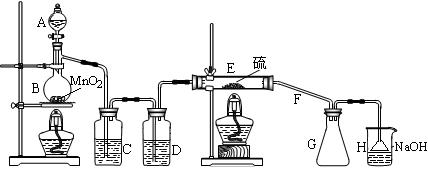
(1)仪器A的名称是,导管F除导气外还起的作用是;
(2)B中反应的离子方程式为;
(3)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分
液漏斗活塞没有堵塞,你认为应采取的措施是;
(4)装置C中的试剂是;如果缺少D装置,则对实验的影响是(用化学方程式表示);
(5)如果在加热E时温度过高,对实验结果的影响是;为了提高S2C12的纯度,关键的操作是控制好温度和。
(6)设计装置H的目的是;烧杯中发生反应的离子方程式
是。