甲酸和乙酸都是弱酸,当他们的浓度均为0.1 0mol/L时,甲酸中的氢离子浓度约为乙酸中的氢离子浓度的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、
0mol/L时,甲酸中的氢离子浓度约为乙酸中的氢离子浓度的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、 b。由此可知( )
b。由此可知( )
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
用NA表示阿伏加德罗常数的值。下列叙述正确的组合是( )
① 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
②含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
③标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA。
④ 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
⑤ 100 mL 1 mol·L-1 AlCl3溶液中含阳离子数大于0.1NA
⑥50 mL 12 mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数小于0.3 NA
⑦13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA
| A.①②⑥ | B.①⑤⑥⑦ | C.②④⑥⑦ | D.③⑤⑥ |
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥根据分散剂的直径大小,分散系可分为溶液、胶体和浊液
| A.②⑤ | B.②③⑥ | C.①②④ | D.②③④⑤ |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3 =bO2↑+cCl2↑+d HClO4 + eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
| A.物质HClO4的氧化性大于HClO3的氧化性 |
| B.若化学计量数a=8,b=3,则8 mol氯酸分解转移电子数为20 NA |
| C.变蓝的淀粉碘化钾试纸褪色可能是发生:4Cl2 + I2 + 6H2O = 12H+ +8Cl-+2IO3- |
| D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的 |
将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+aQ(g);ΔH =b kJ/mol。达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述正确的是
2Z(g)+aQ(g);ΔH =b kJ/mol。达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述正确的是
| A.平衡时X与Y的转化率相等 |
| B.平衡时X的浓度为0.2 mol/L |
| C.在相同实验条件下,若在同一个容器中改为加入2 mol Z和2 mol Q,达到新平衡时Z的体积分数为20% |
| D.若升高温度,Y的体积分数增大,则b<0 |
盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是
| A.在Na2CO3溶液中加入与其溶质等物质的量的冰醋酸,溶液中存在: c(Na+) = c(CH3COOH) + c(CH3COO-)+ c(CO 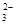 )+c(HCO )+c(HCO ) + c(H2CO3) ) + c(H2CO3) |
| B.NaHCO3溶液中存在:c(H+)+c(H2CO3)=c(OH-) |
| C.10 mL 1.0 mol·L-1CH3COOH溶液中加入0.01 mol的NaOH后,溶液中离子浓度的大小关系为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D.相同条件下,中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量前者大 |