在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H 2 及固体催化剂,使之反应.已知:N2(g)+3H2(g)
2 及固体催化剂,使之反应.已知:N2(g)+3H2(g) 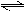 2NH3(g);△H="-92.2" kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
2NH3(g);△H="-92.2" kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
(1)反应达到平衡时,放出的热量_______.
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)欲使H2的转化率提高为原来的两倍,则在其他条件不变的情况下,应将N2的初始量由2mol提高至__________mol.
(3)保持同一温度,在相同的容器中,若起始时加入2molNH3、1molH2 及固体催化剂,反应达到平衡时NH3的体积分数_________.
A.等于0.25 B.大于0.25 C.小于0.25
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线.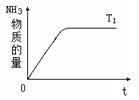
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析: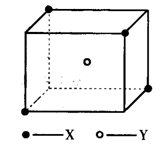
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
二氧化硅晶体是立体的网状结构,其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(1) 二氧化硅是一种晶体。
(2) 二氧化硅晶体中最小的环为元环。
(3) 每个硅原子周围有个氧原子。
下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。
(1) 根据各图表示的结构特点,写出该分子的化学式:
A:________ B:_________ C:________ D:________
(2)与D互为等电子体的化学式
用VSEPR 理论判断:
| 物质 |
孤对电子对数 |
轨道杂化形式 |
分子或离子的形状 |
| NH4+ |
|||
| NCl3 |
按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6
(1)以下分别是哪种元素(用元素符号填空):
A:_____________; C:_____________;D:____________;
(2)B原子的核外电子排布式。
(3)E的原子结构示意图。