某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用____________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液40.00 mL,则废水中Cl2的物质的量浓度为__________________________。
(4)以上实验步骤中有一处明显的操作错误,请指出.
(13分) 下图是实验室中制备气体或验 证气体性质的装置图
证气体性质的装置图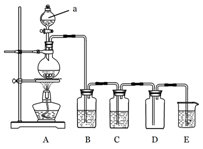
(1)仪器a的名称是_______________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为____________________________________________。
②装置B中的溶液为________________________;烧杯中溶液的作用为__________。
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有漂白性和还原性
实验2:证明碳元素的非金属性比硅元素的强
①B中为少量品红溶液,C中为少量酸性KMnO4溶液,则证明SO2具有漂白性的现象为__________。
②D中应加入足量的____________(填溶液名称),E中加入____________(填溶液名称),证明碳元素的非金属性比硅元素的强的现象为________________________________________。
③为提高实验2的准确性,必须改进的装置为___________________。(填装置代号)
(10分)8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。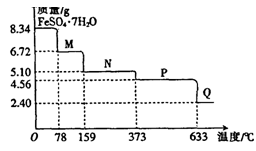
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量(填计算式)。
下图为浓硫酸与铜反应的实验装置图。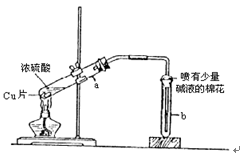
(1)浓硫酸与铜反应的化学方程式为。
(2)实验中,当产生的气体进入盛有品红溶液的仪器b中时,品红溶液将,原因是。
实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:
(1)NaHCO3受热分解的化学方程式是。
(2)加热一段时间后,观察到烧杯中有,
(3)实验结束时为防止倒吸,正确操作是。
①先将导管从液 体中移出,再熄灭酒精灯
体中移出,再熄灭酒精灯
②先熄灭酒精灯,再将导管从液体中移出
铁、铝的混合物进行如下实验: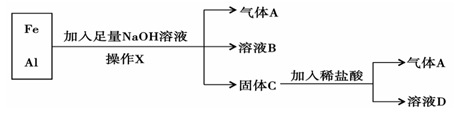
(1)操作X的名称是。(2)气体A是(填化学式)。
(3)A与Cl2混合光照可能发生爆炸,生成(填化学式),A在该反应中作为
(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有(填化学式),溶液D中存在的金属离子为(填化学式)。