10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3—的水解程度增大,故碱性增强,该反应的离子方程式为  。
。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀, 则乙判断正确。试剂X是 。A、Ba(OH)2溶液 B、NaOH溶液 C、BaCl2溶液 D、澄清石灰水
则乙判断正确。试剂X是 。A、Ba(OH)2溶液 B、NaOH溶液 C、BaCl2溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则甲判断正确。
2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示: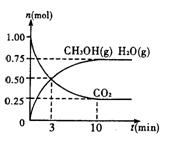
①从反应开始到平衡,氢气的平均反应速 (H2)=_______。
(H2)=_______。
②下列措施中一定不能使 (CH3OH)/ (CO2)增大的是_____。
(CH3OH)/ (CO2)增大的是_____。
| A.降低温度 | B.缩小容器的容积 |
| C.将水蒸气从体系中分离 | D.使用更有效的催化剂 |
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
________________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____________(填“乙醇”或“氧气”),b处电极上发生的电极反应是___________
__________________________________________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
现有氧化铜和铜粉组成的混合物。某同学利用下图所示装置,通过测定混合物质量、实验前后U型管质量变化来确定混合物中氧化铜的质量分数。
回答下列问题:
(1)U形管中可以加入的物质是_________(填序号);
A.浓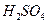 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒
(2)下列步骤按实验操作顺序应为_________(填字母);
A.停止通氢气; B.电热丝通电; C.通人氢气;
D.装置气密性检查; E.电热丝停止通电。
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;
(4)实验结束后,该同学交给老师的实验报告主要项目如图(具体内容已略)。请你根据实验报告的撰写要求,对此份报告作出评价,若已完整,则无需填写,若不完整,请在下面的空格中写出所缺项目______ _______ __;
(5)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案。请用化学方程式表示你设计的新方案的反应原理____ ________,
该方案需测定的数据____________________。
B、D、E为中学化学常见的单质,其中D、E为金属。在一定条件下C、D间能发生反应。各物质转化关系如下图: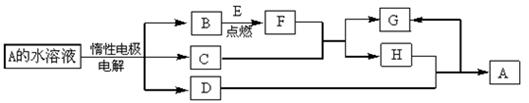
(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知1g E在氧气中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入8.0g A的氧化物后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________。
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是。
(3)120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生bmL CO2,则混合气体中CH4的体积分数为
(保留2位小数)。
②若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表示式是。
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3︰4;E原子最外层电子数比次外层电子数少1。请回答:
(1)E在元素周期表的位置为:_▲_
(2)A、B、C、D原子半径从大到小的顺序为:_▲_(填元素符号)
(3)由A、B两种元素组成的分子有多种,其中一种分子含4个原子,且分子为直线型的对称结构,写出其电子式_▲_。
(4)甲由A、B、C、D四种元素组成的无机盐,既可以与盐酸反应又可以与NaOH溶 液反应,其化学式为_▲_。
液反应,其化学式为_▲_。
(5)由A、C、E三种元素组成的化合物C2A6E2是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出该化合物第一步水解反应的离子方程式_▲_。
(6)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将化合物CA3通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式_▲_。
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为_▲_。