已知在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而F e3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
e3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
| A.向溶液中通入H2S使Fe2+沉淀 |
| B.向溶液中通入Cl2,再通入NH3,调节pH值为4~5 |
| C.加入纯Cu将Fe2+还原为Fe |
| D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4~5 |
与下列装置相关的说法中不正确的是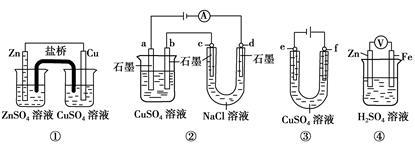
| A.装置①中,盐桥中的K+移向CuSO4溶液 |
| B.装置②中b极析出6.4 g固体时,d极产生2.24 L H2 |
| C.用装置③精炼铜时,f极为粗铜 |
| D.装置④中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
海水总量极大,金、铀等微量元素在海水中的总量自然也大,但从海水中获取这些微量元素的成本很高。其中成本最高的步骤在于
| A.从海水中富集含微量元素的化合物 |
| B.使含微量元素的离子沉淀 |
| C.对含微量元素的混合物进行提纯 |
| D.从化合物中冶炼这些单质 |
化学与能源开发、环境保护、生产生活等密切相关。下列说法正确的是
| A.开发利用可燃冰是缓解能源紧缺的唯一途径 |
| B.将废电池深埋,可以避免其中的重金属污染 |
| C.“地沟油”对人体的危害极大,严禁用做食用油 |
| D.食品保鲜膜、食品袋的主要成分都是聚氯乙烯 |
在三个密闭容器中分别充入A、B、C三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序为p(B)>p(A)>p(C),则A、B、C分别是
A.Ne、H2、O2B.O2、N2、H2
C.NO、CO2、H2D.NH3、O2、NO2
ag镁铝合金投入x mL 2mol/L的盐酸中,金属完全溶解,再加入y mL 1mol/L的NaOH溶液,沉淀达到最大值,质量为(a+1.7)g ,则下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子数为0.1NA | B.产生的H2在标况下体积为1.12L |
| C.x一定等于50 | D.a的取值范围为0.9<a<1.2 |