下述实验不能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将AlCl 3溶液蒸干灼烧 |
制备Al 2O 3 |
| B |
向沸水中滴加几滴FeCl 3饱和溶液,继续加热至红褐色 |
制备Fe(OH) 3胶体 |
| C |
向某溶液中加入稀H 2SO 4,将产生的气体通入澄清石灰水 |
检验溶液中是否含有 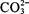 |
| D |
相同温度下,测定浓度分别为0.1 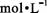 的Na 2CO 3和CH 3COONa溶液的pH 的Na 2CO 3和CH 3COONa溶液的pH |
比较  和 和 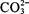 结合 结合 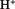 的能力强弱 的能力强弱 |
下列关于苯酚的叙述中,错误的是
| A.其水溶液显强酸性,俗称石炭酸 |
| B.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 |
| C.其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 |
| D.碳酸氢钠溶液中滴入苯酚的水溶液后会放出二氧化碳 |
有碳原子数相同的烯烃、炔烃混合气aL,完全燃烧后生成bLCO2和cL水蒸气(温度、压强与原混合气相同),若a∶b∶c=3∶6∶4 ,则下列叙述中正确的是
,则下列叙述中正确的是
| A.原混合气为体积比是1∶1的丙烯和丙炔 |
| B.原混合气为任意体积比的乙烯和乙炔 |
| C.原混合气为体积比为2∶1的丁烯和丁炔 |
| D.原混合气为体积比为1∶2的乙烯和乙炔 |
盆烯是近年合成的一种有机物,它的分子 结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是
结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是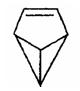
A.盆烯是苯的一种同分异构体
B.盆烯分子中所有的碳原子不可能在同一平面上
C.盆烯是乙烯的一种同系物
D.盆烯在一定条件下可以发生加成反应
某有机物含C 60%,H 13.33%,0.2mol该有机物质量为12g,则它的分子式为
| A.CH4 | B.C3H8O | C.C2H4O2 | D.CH2O |
下列实验操作正确的是
| A.用酸性高锰酸钾溶液鉴别己烷、苯、甲苯 |
| B.用水鉴别苯和溴苯 |
| C.提取溶解在水中的少量碘:加入裂化汽油振荡 |
D.制取溴苯:将铁屑、液溴、苯充分 混合后加热 混合后加热 |