在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A.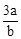 mol.L-1 mol.L-1 |
B.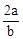 mol.L-1 mol.L-1 |
C. mol.L-1 mol.L-1 |
D.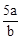 mol.L-1 mol.L-1 |
下列化学实验事实及解释都正确的是
| A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶液已经变质 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 |
在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后
| A.溶液的pH增大 | B.Na+ 和CO32-的浓度减小 |
| C.溶液的浓度增大 | D.溶液的浓度不变,有晶体析出 |
以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是
A.Mg片作负极,电极反应:Mg-2e-  Mg2+ Mg2+ |
B.Al片作负极,电极反应:Al+4OH- -3e-  AlO2- +2H2 O AlO2- +2H2 O |
| C.电子从Mg电极沿导线流向Al电极 |
| D.Al片上有气泡产生 |
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.v(A) = 0.7mol·L-1·min-1B.v(B) = 0.3mol·L-1·min-1
C.v(C) = 0.9mol·L-1·min-1 D.v(D) = 1.1mol·L-1·min-1
根据热化学方程式(在101 kPa时):S(s)+O2(g)=SO2(g) ΔH=-297.2kJ/mol
分析下列说法中不正确的是
| A.S的燃烧热为 297.2 kJ/mol |
| B.S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ |
| C.S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ |
| D.形成1 mol SO 2 中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |