现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
下图是反应A2(g)+3B2(g) 2C(g)△H<0
2C(g)△H<0
的平衡移动图,影响该反应平衡移动的原因是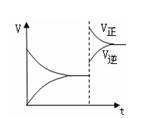
| A.升高温度 | B.增大反应物浓度 |
| C.增大压强 | D.使用催化剂 |
下列事实,不能用勒夏特列原理解释的是
| A.实验室用排饱和食盐水而不用排水法收集氯气 |
| B.加催化剂,使N2和H2在一定条件下转化为NH3 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.光照新制的氯水时,溶液中c(H+)增大 |
高温下,某反应达平衡,平衡常数K= , 恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强, H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为 CO + H2O CO2 + H2 CO2 + H2 |
说明可逆反应A(g)+B(g) C(g)+D(g)在一定条件下已达到化学平衡状态的事实是。
C(g)+D(g)在一定条件下已达到化学平衡状态的事实是。
A.容器内压强不随时间的变化而变化 B.容器内A、B、C、D四者共存
C.A、D的消耗速率相等 D.C、D的生成速率相等
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应: 2A(g)+B(g)=2C(g)。若经2s后,测得C的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1② 用物质 B表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1其中正确的是
| A.① ③ | B.① ④ | C.② ③ | D.③ ④ |