工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是 。
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO2气体。为此设计了下列探究实验装置。图中夹持仪器省略,M中盛有澄清石灰水。
①认为气体Y中还含有CO2的理由是 (用化学方程式表)。
②装置A中试剂的作用是 。
③为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是 。
某化学反应2A (g)  B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表: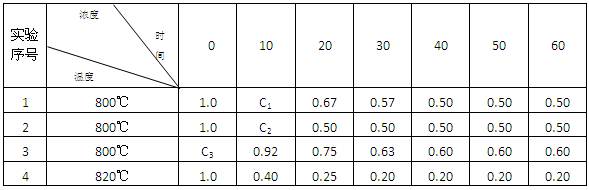
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是min,实验4达到平衡的时间是min.
(2)C1C2(填“大于”“小于” “等于”);C3= mol•L-1
(3)实验4比实验1的反应速率(填“快”或“慢”),原因是
(4)如果2A (g)  B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,放出的热量多,理由是。
B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,放出的热量多,理由是。
(7分)已知:CH3CH2OH+NaBr+H2SO4(浓) 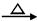 CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下: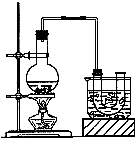
①按右图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
。
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取(填“上层”或“下层”)液体。为了除去其中的杂质,最好选择下列试剂中的(填序号)。
| A.Na2SO3溶液 | B.H2O | C.NaOH溶液 | D.CCl4 |
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行(填操作名称)。
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
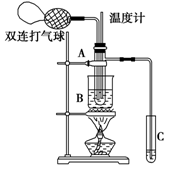
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、铜粉,试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全。有关物质的沸点如下:
| 物质 |
乙醛 |
乙酸 |
甘油 |
水 |
| 沸点/℃ |
20.8 |
117.9 |
290 |
100 |
请完成下列问题:
(1)试管A在60℃~80℃时发生的主要反应的化学方程式为(根据题意注明反应条件)
______________________________________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内主要反应完成后,温度计水银球的位置应在_____________,目的是____________________________。
(3)烧杯B内盛装甘油,甘油浴的作用是:
_____________________________________,______________________________________。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。该方案为(简述操作过程):__________________________________________________
实验室用托盘天平等仪器配制500mL 1mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放人小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转人500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度l—2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)计算需要NaCl晶体 g。
(2)实验操作步骤的正确顺序为(填序号)
(3)使用容量瓶前必须进行的一步操作是 。
(4)配制过程中,其他操作都正确,下列操作会引起浓度偏高的是 。
①未洗涤烧杯、玻璃棒②容量瓶不干燥,含有少量蒸馏水③定容时俯视标线④定容时仰视标线⑤超过刻度线,吸出一部分水;⑥摇匀后液面下降,补充水。
(5)配制上述溶液需要用到的玻璃仪器是下图中的(填编号):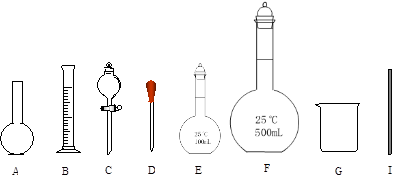
指出下面3个实验中各存在的一个错误: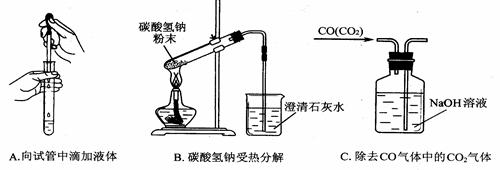
A___________________、B_____________________、C__________________