从固体混合物A出发可以发生如下框图所示的一系列变化。
(1)在实验室,气体C的检验方法是 。
(2)操作②的名称是 ,该操作所使用的玻璃仪器有 。
(3)写出下列反应的离子方程式:
反应③ ;
反应④ 。
实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是 (填序号)。
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.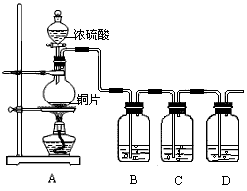
请回答下列问题.
(1)某同学拧开分液漏斗下面的活塞后发现开始时能流出,但一会就停止了,情分析原因:___________________。
(2)铜和浓硫酸反应的化学方程式为__________________________。
(3)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为 SO2具有__________(填选项的字母,下同), C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有_______________.
A.氧化性 B.还原性 C.漂白性
(4)D瓶中盛有NaOH溶液,作用是______________.
实验室需要配制240 mL 0.2 mol·L-1的Na2CO3溶液,回答下列问题:
(1)需称量Na2CO3·10H2O的质量 g。
(2)配制时各步骤操作如下,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,将洗涤液均注入容量瓶,振荡
B.用称取所需质量的Na2CO3·10H2O固体,放入烧杯中,再加入适量的蒸馏水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的溶液沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1﹣2 cm处
(3)下列操作会使所配溶液浓度偏高的是 。
A.所选用的溶质已经变质,部分已失去了结晶水
B.转移前,容量瓶中含有少量蒸馏水
C.将未冷却的溶液沿玻璃棒注入容量瓶中
D.定容时,仰视刻度线
E.称量时误操作为“左码右物”
F.定容后使溶液混匀静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线
(4)取所配制的碳酸钠溶液125 mL,向其加入125 mL 0.3 mol·L-1的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出)________mL;设反应后溶液的体积为250 mL,则反应后溶液中Na+的物质的量浓度为____________。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
A B CDE F
请回答下列问题:
(1)B装置的名称是________________;E装置的作用____________________。
(2)写出F中发生反应的离子反应方程式 。
(3)上述制氨为快速制氨,实验室常用氯化铵和氢氧化钙制备,其化学方程式为: 。
(4)装置A的烧瓶中装有生石灰,随着浓氨水的滴入,氨气产生的原因是_________。
(5)通入C装置的两根导管左边较长、右边较短,目的是_____________________________。
(6)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:___________________________。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)________________。
焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶。其性质活泼,具有强还原性,在食品加工中作防腐剂、漂白剂、疏松剂。某实验小组拟采用如图1装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为 .如果想控制反应速度,如图2中可选用的发生装置是 (填写字母).
(2)工业上为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)装置Ⅱ中发生反应的化学方程式为:2 NaHSO3=Na2S2O5+ H2O当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是 ;某同学需要420mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为 ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是 .
(5)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为 (填序号).
(6)工业制备焦亚硫酸钠(Na2S2O5)的过程如图:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
①实验室制取氨气的化学方程式: 。
②“灼烧”时发生反应的化学方程式: 。
③已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
④副产品X的化学式是: ;可循环利用的物质是:__________________。
⑤为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。
某化学兴趣小组做了Na2CO3的相关性质实验,请按要求回答问题:
第一步:称量10.6g Na2CO3固体全部溶于水中,配成100mL溶液;
第二步:量取5.0mL上述溶液于试管中,再滴加2滴酚酞溶液,观察到的现象是 ,请说明原因 (用离子方程式表示);
第三步:将第二步试管中的溶液均分成2份,一份微微加热,观察到的现象是 ,请说明原因: (用文字说明);另一份慢慢滴加1.0 mol/L CaCl2溶液,观察到的现象是 ;
第四步:再量取4mL Na2CO3溶液于干净的试管中,缓慢滴加1.0mol/L HCl溶液2mL,滴加过程中始终没有观察到气泡产生,请说明原因 (用离子方程式表示)。