某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生找出以下原因,其中不会使溶液浓度偏低的是( )
| A.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中 |
| B.容量瓶刚用蒸馏水洗净,没有烘干 |
| C.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 |
| D.定容时仰视刻度线 |
将一定量a%的NaOH稀溶液加热蒸发掉b g水,得到溶液体积为V mL,溶质的质量分数为2a%。蒸发后所得溶液中溶质的物质的量浓度为()
| A.ab/(80V) mol·L-1 |
| B.ab/(2 000V) mol·L-1 |
| C.250ab/V mol·L-1 |
| D.0.5ab/V mol·L-1 |
已知气体的体积不仅与分子数的多少有关,还与温度、压强等外界条件有关,在标准状况(273 K,101 kPa)下,1 mol任何气体的体积约为22.4 L。根据上述结论,下列说法正确的是(已知NA为阿伏加德罗常数)()
| A.标准状况下,22.4 L H2O所含的水分子数为NA |
| B.常温常压下,16 g氧气所占的体积为11.2 L |
| C.标准状况下,2NA个二氧化碳分子所占的体积为44.8 L |
| D.同温同压下,1 mol任何物质所占的体积相等 |
用Na表示阿伏加德罗常数,下列叙述正确的是()
| A.0.1 mol·L-1稀硫酸100 mL中含有的硫酸根个数为0.1NA |
B.1 mol  (碳正离子)中含有的电子数为10NA (碳正离子)中含有的电子数为10NA |
| C.2.4 g金属镁与足量的盐酸反应,转移电子数为2NA |
| D.12.4 g白磷中含有的磷原子数为04 NA |
下图是海水蒸馏的装置示意图,下列有关海水蒸馏的叙述正确的是()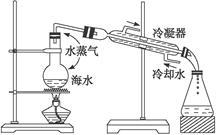
| A.本装置缺少温度计,所以无法进行海水蒸馏 |
| B.海水经过本装置的蒸镏后,锥形瓶中得到的是淡水 |
| C.装置中冷凝器中水流的方向不对,应该为上口进水,下口出水,便于水流下 |
| D.海水蒸馏前须加入沸石以防止暴沸 |
右图是某同学设计的“自过滤”器,能在无人在场的情况下实现顺利过滤,其中装置的关键是导管a的设计,下列设计能达到“自过滤”目的的是()
| A.导管的上端应该在圆底烧瓶中的液面以上,下端应在漏斗中的滤纸边缘以上 |
| B.导管的上端应该在圆底烧瓶中的液面以下,下端应在漏斗中的滤纸边缘以上 |
| C.导管的上端应该在圆底烧瓶中的液面以上,下端应在漏斗中的滤纸边缘以下 |
| D.导管的上端应该在圆底烧瓶中的液面以下,下端应在漏斗中的滤纸边缘以下 |