(10分)某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检验整个装置的气密性:________________________ ________________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是_____ _,作用是_____________________________________________
(4)在实验室通常制法中,装置A还可作为下列______ (填序号)气体的发生装置.
①HCl ②H2 ③O2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______ mol/L.
分某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)写出装置A中发生反应的化学方程式:
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄
红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和
假设二:存在三种成分: NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 |
预期现象和结论 |
||
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|||
| 步骤2: |
①若无明显现象,证明固体中不含Na2CO3 ②若溶液变浑浊,证明固体中含 Na2CO3 |
||
| 步骤3: |
|
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
硫酸铜是一种用途广泛的化工原料。某学习小组把适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全.通过蒸发、结晶得到硫酸铜晶体(装置如图I、Ⅱ所示)
(1)图Ⅱ是图I的改进装置。其优点有。
(2)为符合绿色化学的要求,该学习小组进行了如下探究:将氧气直接通入到铜粉与稀硫酸的混合物中,发现常温下几乎不反应,但向混合物中加入FeSO4后再通入氧气,反应则立即发生试用离子方程式表示反应发生的原理___________________________________;在该反应中FeSO4的作用是__________________。
(3)为寻找更加适宜的氧化剂,该小组又进行了如下探究:称量3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50℃,加入18 mL 10%的H2O2,反应30 min后升温到60℃,持续反应1小时后铜丝反应完全。蒸发、冷却、结晶,过滤时用少量95%的酒精淋洗晾干,得到10 g CuSO4·5H2O。
①该实验铜丝被氧化的原理是(用离子方程式表示)_____________________________。
②反应过程中温度不宜过高的原因是________________________________________,过滤时采用酒精淋洗的优点是。
③该小组得到硫酸铜晶体的实际产率是_____________________。
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置: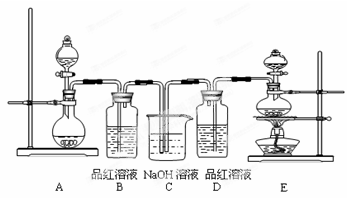
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质 、
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,分别取少量B、D两个装置中的液体于试管中加热,两个试管中的现象分别为:
B
D
(3)装置C的作用是
(4)写出等物质的量的Cl2与SO2反应的离子方程式
某化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。设计了如下图所示的实验装置(固定装置已略去)。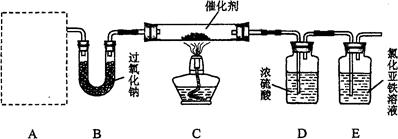
(1)若A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和______(填序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
(2)装置B的作用是_________________________________________________________。
(3)装置C中发生反应的化学方程式为_________________________________________。
(4)若A、B中药品足量,则可以观察到E中溶液发生变化,其现象是______________;
请设计实验进行检验。
(5)某同学从安全与环保的角度考虑,指出该装置有两处明显的缺陷。你认为这两处缺陷是:______________________________、______________________________。
(12分)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)="a" g,m(H2O)="b" g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
① CuO未完全起反应② CuO不干燥
③ CuO中混有不反应的杂质④ 碱石灰不干燥⑤ NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定________和_________,或_______和________达到实验目的。