航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4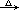 N2↑+4H2O+Cl2↑+2O2↑+Q。下列对此反应的叙述中错误的是 ( )
N2↑+4H2O+Cl2↑+2O2↑+Q。下列对此反应的叙述中错误的是 ( )
| A.上述反应中,每生成1molN2则转移电子6mol |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵既起氧化剂,又起还原剂作用 |
下列各表述与示意图一致的是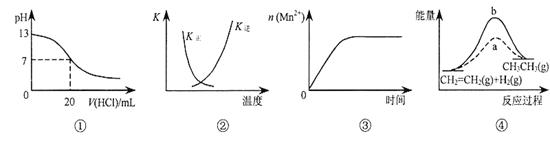
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g)+ O2(g) 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
| A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-) |
| B.c(HSO3-) + c(SO32-) = 0.1mol·L-1 |
| C.c(SO32-) < c(H2SO3) |
| D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-) |
下列事实不能用勒夏特列原理解释的是
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)  K(g)+NaCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
| A.②⑥ | B.①②③ | C.②⑤⑥ | D.①③④⑤ |
用铂电极电解100mL HNO3 与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为
| A.1mol·L-1 | B.2 mol·L-1 |
| C.2.5 mol·L-1 | D.3 mol·L-1 |
已知H2(g)+1/2O2(g) =H2O(l);△H= -285.8 kJ·molˉ1
CO(g)+1/2O2(g)=CO2 (g);△H= -282.9 kJ·molˉ1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
| A.2∶1 | B.1∶2 | C.1∶1 | D.2∶3 |