某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。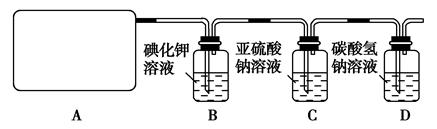
试回答:
(1)该实验中A部分的装置是________(填写装置的序号);
(2)B中反应的化学方程式是 。
(3)写出C中反应的离子方程式 ,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_________________ 。
(4)写出在D装置中发生反应的离子方程式 。
(5)该实验存在明显的缺陷是__________________________________。
(6)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL。则该漂白粉中Ca(ClO)2的质量分数为___ _____。
根据如图所示实验装置图,完成以下问题:
(1)这套装置可实现______________________等实验目的。
(2)仪器连接安装好进行实验前如何检查装置的气密性?答:____________________________
________________________________________________________________________________
_______________________________________________________________________________。
(3)实验时,点燃B处的酒精灯,先___________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是_____________________,发生的主要反应的化学方程式为_____________________。当反应进行一段时间后,移去酒精灯,继续不断的缓缓鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个________反应。
(4)装置C的作用是_______________,能在此处观察到的现象是________________________。
(5)D装置产生的现象是__________,发生反应的化学方程式是_________________________。
(6)E装置的试管中所得溶液的成分可能有_____________________ (写化学式)。
某化学小组采用类似制乙酸乙酯的装置(如图Ⅰ)以环己醇制备环己烯。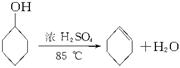
已知:
| 密度(g·cm-3) |
熔点(℃)沸 |
点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
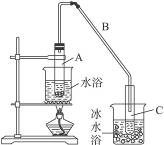
图Ⅰ
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______________。
②试管C置于冰水浴中的目的是_________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。中和饱和食盐水,振荡、静置、分层,环己烯在_______________层(填“上”或“下”),分液后用_______________(填入编号)洗涤。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
图Ⅱ
②再将环己烯按图Ⅱ装置蒸馏,冷却水从____________口进入。蒸馏时要加入生石灰,目的是____________。
③收集产品时,控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用高锰酸钾酸性溶液b.用金属钠c.测定沸点
乙醇的沸点是78 ℃,能与水以任意比例混溶。乙醚(CH3CH2OCH2CH3)的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理如下:
2CH3CH2OH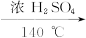 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O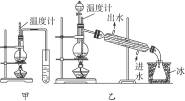
图6-3
(1)图6-3中甲和乙是两套实验室制乙醚的装置,选择装置__________最合适,理由是______________________________。
(2)反应液中应加入沸石,其作用是________________________________________。
(3)反应中温度计的位置应在____________________。
(4)用装置乙制得的乙醚中可能含有大量杂质,这种杂质是__________,除去这种杂质的简易方法是____________________。
(5)如果反应温度太高将会发生__________反应,产物是__________。
为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如下图所示。
请回答以下问题:
(1)测量氢气体积的正确装置是___________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是___________(填写编号)。
A.防止无水酒精挥发B.保证实验装置不漏气C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是____________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,量取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为___________,由此可确定乙醇的结构式为___________,而不是______________________。
(5)实验所测定的结果偏高,可能引起的原因是______________________(填写编号)。
A.本实验在室温下进行B.无水酒精中混有微量甲醇C.无水酒精与钠的反应不够完全
工业上用丙烯制取甘油的过程可简单表示如下:
其中B、C互为同分异构体,试写出①—④步反应的化学方程式(有机物用结构简式表示)。