某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①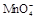 在酸性环境下的还原产物是
在酸性环境下的还原产物是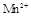 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入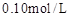 的草酸溶液
的草酸溶液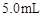 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
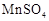 固体 固体 |
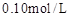 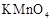 溶液 溶液 |
褪色时间 |
| 1 |
65℃ |
— |
— |
1.0mL |
100s |
| 2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
| 3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
| 4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体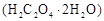 样品
样品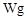 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述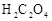 溶液与酸性
溶液与酸性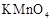 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
(11分)某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:
①480 mL 0.5 mol/L 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________
_________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意
。
溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。实验室制取溴乙烷的反应如下:
NaBr+H2SO4(浓) NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
已知反应物的用量:①NaBr(s) 0.3 mol,②浓硫酸36 mL(98%、密度1.84 g•cm–3),
③乙醇0.25 mol,④水25 mL,其中乙醇的密度为水的密度的4/5。
试回答:
(1)仅用如下图所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器(相关胶塞上已打合适的孔,胶管未画出。)的选择和连接顺序为(填数字)。
(2)在实验过程中,考虑到浓硫酸性质的特殊性,试剂加入的合理顺序为________________(请填写试剂的编号);
(3)若试剂加入过快,可看到烧瓶内有红棕色气体产生,写出反应的化学方程式:
。
(4)判定有溴乙烷生成的现象是__________________________。从棕黄色的粗溴乙烷制取无色的溴乙烷,第一步可以加入蒸馏水或NaHSO3溶液,本操作中通常使用的仪器是__________。
(5)本实验的产率为60%,则可制取溴乙烷g。
含苯酚的工业废水处理的流程图如下: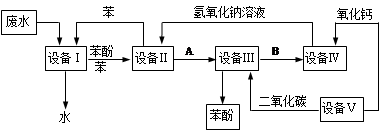
(1) 上述流程里,设备Ⅰ中进行的是_______________操作(填写操作名称)。
(2) 由设备Ⅱ进入设备Ⅲ的物质A是________。由设备Ⅲ进入设备Ⅳ的物质B是________。
(3) 在设备Ⅲ中发生反应的化学方程式为_________________________________________。
(4) 在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和_________,通过操作_________ (填写操作名称)可以使产物相互分离。
(5)上图中能循环使用的物质是C6H6、CaO、___________、___________。
某研究性学习小组对双氧水开展如下研究。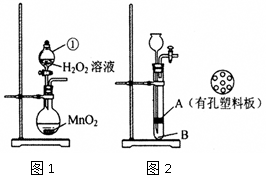
(1)图1中仪器①的名称,该装置中发生的化学方程式为
。图1装置也可以用于实验室制气体(只填一种即可)
(2)小杨同学将MnO2与水泥按一定比例加水混合、凝固,制作成小块状固体,加入图2装置中制氧气,以方便实验结束回收二氧化锰。实验前检查该装置气密性的方法是:
打开旋塞,从长颈漏斗口注水至,关闭旋塞,继续注水,使漏斗中液面略高于试管中液面,一段时间后,高度差不变,说明气密性良好。其中块状固体应放置在处(填“A”或“B”)
(3)利用图2装置反应一段时间后,需停止反应,其操作是。
(4)Cu与稀硫酸不能直接反应,但滴加H2O2溶液并加热,能生成水和一种蓝色溶液。则该反应的化学方程式为。
欲用质量分数为98%的浓硫酸(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
简要回答下列问题:
(1)量取所需浓硫酸的体积为_____________mL。
(2)如果实验室有15 mL、 20mL、 50mL的量筒,应选用_________mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取,使结果浓度_______(填“偏高”“偏低”“无影响”)
(3)下面是某学生的操作过程:
a.检查容量瓶是否漏水;
b.用(2)中选择的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500 mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1 cm~2 cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用。
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加)。
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________;
⑤_________________________________________________________。