实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下: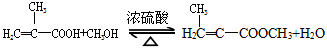
| 药品 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
溶解性 |
密度(g•cm-3) |
| 甲醇 |
32 |
-98 |
-64.5 |
与水混溶,易溶于有机溶剂 |
0.79 |
| 甲基丙烯酸 |
86 |
15 |
161 |
溶于热水,易溶于有机剂 |
1.01 |
| 甲基丙烯酸甲酯 |
100 |
-48 |
100 |
微溶于水,易溶于有机溶剂 |
0.944 |
实验步骤:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是______________________。
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理____________________.但是浓硫酸过多,产率降低,原因是________________________.
(3)上述实验可能生成的副产物结构简式为_______________(填一种即可)
(4)试剂X宜选择_________________.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_______。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是__________.
a.分水器收集的水里含甲酯 b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质 d.产品在洗涤、蒸发过程中有损失
1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm ,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
(1)写出制备1,2-二溴乙烷的化学方程式________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是__________。
(3)容器b中NaOH溶液的作用是__________,容器d中NaOH溶液的作用是__________。
(4)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是__________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因________________.
碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。
请回答:
(1)步骤①中灼烧海带用到的实验仪器是______________________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤③的实验操作是_______________________。
(3)步骤④中反应的离子方程式是_____________________________________。
(4)步骤⑤中,可以选择的有机溶剂是__________________(填序号)。
a. 乙酸 b. 四氯化碳 c. 酒精 d. 苯
(5)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: __________________________________________________________________________。
(6)因过量的Cl2会与I2反应,所以步骤④中加入的氯水应保持适量。为证明此说法,某同学做如下实验:取少量碘水,滴加氯水,观察到碘水逐渐褪色,经检验生成物含有IO3-。该反应的化学方程式是_________________________________。
葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖) 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是。
(4)一段时间后,C中白色沉淀溶解,其原因是__________________________。
(5)装置D的作用是____________________________________________。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: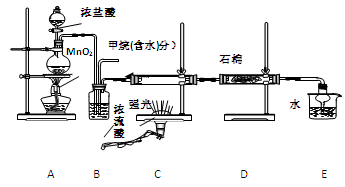
(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③
|
(2) 设V(Cl2)/V(CH4)=x,若理论上欲取代反应获得最多的氯化氢则x≥
(3) D装置的石棉中均匀混有KI粉末其作用是 。