高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O)。

①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如下图。

导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入 ,并控制溶液pH ;
② ;
③检验SO42-是否被洗涤干净;(实验操作: )
④用少量C2H5OH洗涤;
⑤ 。
【改编】(15分)过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素,反应的化学方程式为: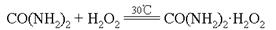 。过氧化尿素的部分性质如下:
。过氧化尿素的部分性质如下:
| 分子式 |
外观 |
热分解温度 |
熔点 |
溶解性 |
| CO(NH2)2·H2O2 |
白色固体 |
45℃ |
75~85℃ |
易溶于水、有机溶剂 |
合成过氧尿素的流程及反应装置图如下: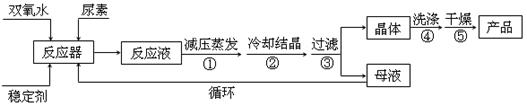
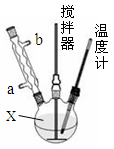
请回答下列问题:
(1)仪器X的名称是 ,冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 ;
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步聚①采用减压蒸发的原因是 ;
(5)下列选项中最适合作为步聚④的洗涤液是 ;
a.冰水
b.热水
c.饱和NaCl溶液
d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol·L-1 H2SO4,用0.1000 mol·L-1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中过氧化尿素的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
【改编】(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g) + CO2(g)  NH2COONH4(s)ΔH<0
NH2COONH4(s)ΔH<0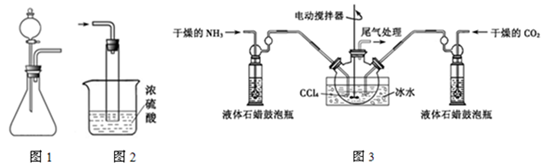
(1)如用图1装置制取氨气,你所选择的试剂是 。制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是 。
(3)液体石蜡鼓泡瓶的作用是 。
(4)从反应后的混合物中分离出产品的实验方法是 (填写操作名称);为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40℃以下烘干
(5)尾气处理装置如图2所示。双通玻璃管的作用 ;浓硫酸的作用 。
(6)称取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为 。(精确到2位小数)
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图所示的实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。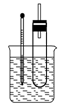
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是___________________________;试管口安装一长导管的作用是________________________________。
(2)观察到________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是________________________,检验的方法是_________________________________
(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用下图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。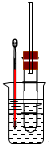
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到_________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_______ ____。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是____________,检验的方法是 (需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
为确定某卤代烃分子中所含卤原子的种类,可按下列步骤进行实验:
a.取少量该卤代烃液体;
b.加入适量NaOH溶液,加热;
c.冷却后加入稀硝酸酸化;
d.加入AgNO3溶液,观察反应现象。
回答下列问题:
(1)①步骤b的目的是_______________________________________________;
②步骤c的目的是_______________________________________________。
(2)若加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤素原子是____(填元素符号)。
(3)能否向该卤代烃中直接加AgNO3溶液确定卤素原子的种类?为什么?