同学们在做铜与浓硝酸反应的实验时,发现反应后溶液里绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中不可行的是
| A.加水稀释绿色溶液,观察颜色变化 |
| B.加热该绿色溶液,观察颜色变化 |
C.向该绿色溶液中通 入氮气,观察颜色变化 入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
下列说法正确的是 ()
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
阿伏加德罗常数约为6.02×1023 mol-1,下列说法中正确的是
| A.4 g重水(D2O)中所含质子数为0.2×6.02×1023 |
| B.4.48 L N2与CO的混合物所含分子数为0.2×6.02×1023 |
| C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2×6.02×1023 |
| D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2×6.02×1023 |
NO因污染空气而“臭名昭著”,而奇妙的作用也使其成为“明星分子”。如可用于制HNO3、肥料、炸药、促进血管扩张、促进免疫功能、增强记忆等。下列各组物质中,不能生成NO的是()
| A.Cu + HNO3(稀) | B.N2 + O2 | C.NH4Cl + O2 | D.NO2 + H2O |
短周期元素X、Y、Z在周期表中位置如图。下列说法正确的是()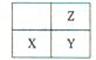
| A.若它们均为金属元素,则X与氧元素组成的物质有多种 |
| B.若它们的原子最外层电子数之和为11,则它们均为非金属元素 |
| C.Z单质一定不能置换出Y单质。 |
| D.Z元素的最高化合价一定等于Y元素 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知: 1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.+1220 kJ/mol | C.-1220 kJ/mol | D.+1780 kJ/mol |