用NA表示阿伏加德罗常数,下列说法中正确的是
①18gD2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4LSO3的物质的量为1mol ⑤4℃时5.4mL的水所含的原子总数为0.9NA ⑥0.1molOH-含0.1NA个电子 ⑦1mol Na2O2与水完全反应时转移电子数为2NA
| A.③⑤⑦ | B.③⑤ |
| C.①②④⑦ | D.③④⑤⑥ |
下列类型的反应,一定发生电子转移的是()
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
下列各组离子反应可用H++OH-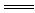 H2O表示的是()
H2O表示的是()
| A.氢氧化钡和硫酸 | B.氢氧化铁和盐酸 |
| C.硝酸和氢氧化钠 | D.碳酸氢钠和氢氧化钠 |
下列关于钠的叙述中,不正确的是()
| A.钠燃烧时发出黄色的火焰,生成过氧化钠 |
| B.钠应保存在煤油中 |
| C.钠有很强的还原性 |
| D.金属钠着火时,可以用水灭火 |
下列物质中,能够导电的电解质是()
| A.Cu丝 | B.熔融的MgCl2 | C.NaCl溶液 | D.蔗糖 |
下列电离方程式错误的是()
A.Ba(OH)2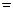 Ba2+ +2OH- Ba2+ +2OH- |
B.NaHSO4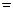 Na+ +H+ +SO42- Na+ +H+ +SO42- |
C.MgC l2 l2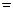 Mg2+ +2Cl- Mg2+ +2Cl- |
D.NaHCO3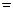 Na+ +H+ +CO32- Na+ +H+ +CO32- |