能够说明H2(g)+I2(g) 2HI(g)(HI为无色气体)已达平衡状态的是( )
2HI(g)(HI为无色气体)已达平衡状态的是( )
| A.一个H-H键断裂的同时有两个H-I键形成 |
| B.v (H2)正= v (HI) 逆时的状态 |
| C.恒温恒容时,反应混合物总质量保持不变的状态 |
| D.恒温恒容时,体系的颜色不再发生变化的状态 |
下列化学用语中正确的是
A.氯化钠的电子式为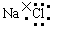 |
B.镁的原子结构示意图为 |
C.氯化氢分子的形成过程可用电子式表示为 |
D.重水的化学式为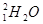 (或D2O) (或D2O) |
月球中的每百吨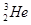 聚变所释放出的能量相当于目前人类一年消耗的能量;地球上氦元素主要以
聚变所释放出的能量相当于目前人类一年消耗的能量;地球上氦元素主要以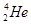 的形式存在。下列说法中正确的是
的形式存在。下列说法中正确的是
A.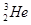 比 比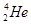 多一个中子 多一个中子 |
B.氦原子的质量数一定为3 |
| C.一个氦气分子中含有两个氦原子 | D.氦(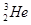 )气的摩尔质量为3g·mol-1 )气的摩尔质量为3g·mol-1 |
下列说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),则该溶液的pH>7
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2 c(Na+)=c(CH3COO-)
C.饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,所得溶液的pH会增大
D.0.2 mol·L-1 NH4NO3和0.l mol·L-1 NaOH溶液等体积混合后:
c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+)
有一反应:2A+B 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是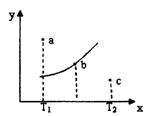
A.该反应是放热反应
B. T1温度下a点表示若想达到平衡,可以采取增大压强的方法
C. b点时混合气体的平均摩尔质量不再变化
D.c点可表示v(正)<v(逆)
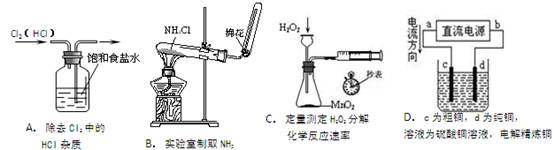
下列装置所示的实验中,能达到实验目的的是