某些化学反应可表示为:A+B=C+D十H2O(未配平,条件略)。请回答:
(1)若A为主族元素,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色。请写出A与B的稀溶液反应的化学方程 。
(2)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式 。
(3)若A为黑色固体,C是黄绿色的单质气体。当产生标准状况下33.6LC气体时,参加反应的A的质量为 。
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物。则: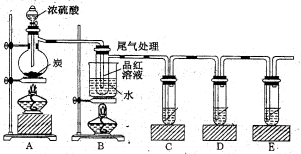
若证明有水生成,需要在.A、B之间加装盛有 的干燥管。若证明生成CO2,需要C试管盛放 (填化学式)溶液。装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象 ;该实验的尾气可采用NaOH溶液吸收,有关反应离子方程式为 。
某化学实验小组拟用以下装置由乙醇与浓硫酸共热制备乙烯,且进行乙烯的催化氧化实验。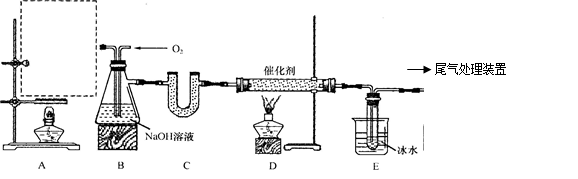
(1)在A处虚线框内绘出该实验装置图。
(2)制取乙烯的化学方程式为。
(3)装置B中盛有NaOH溶液,除了便于观察乙烯和氧气的流速以外,还具有的作用是:
①;②。
(4)若E中收集到的物质为CH3CHO,则D中发生反应的化学方程式为。
(5)用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是(填字母序号)。
A.乙醇部分挥发 B.乙醇部分生成乙醚
C.乙醇被氧化为C、CO、CO2D.乙醇消去成乙炔
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的摩尔质量为 ___________ |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为________________ |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团_____________、_____________ |
(4)A的核磁共振氢谱如下图: |
(4)综上所述,A的结构简式为 __________________________ |
(5)试举两种常见有机物,它们与A无论以何种比例混合,只要混合物的总质量一定,则完全燃烧后混合物所消耗的O2以及燃烧后生成的H2O和CO2的量均为定值_________________
(6)A在一定条件下可以生成C6H8O4的环状化合物,写出其发生反应的化学方程式
_________________________________________________________________________________
Ⅰ下列实验操作、现象、结论、说法不正确的是_______________(填序号)
①.苯酚沾在手上立即用酒精洗涤
②.除去淀粉中的少量氯化钠,可以加蒸馏水,用渗析的方法
③.向蛋白质溶液中加入CuSO4盐溶液会使蛋白质发生盐析
④.制取乙酸乙酯用如右图所示的实验装置
⑤.区别植物油和直馏汽油的正确方法是将它们分别滴入溴水当中,稍加振荡,
观察溴水的颜色是否褪去
⑥.在溴乙烷中加入NaOH水溶液并加热,水层中加入足量HNO3酸化,再滴入AgNO3溶液以检验其是否发生水解
⑦.皂化反应完成后加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析
⑧.在蔗糖溶液中滴加几滴稀硫酸,微热,加入新制Cu(OH)2悬浊液煮沸,通过观察有无砖红色沉淀生成来检验蔗糖水解产物是否含有葡萄糖
Ⅱ 实验室需要0.5 mol/L硫酸溶液480mL。回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。
(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。
(3)配制时,该同学的操作顺序如下,请将操作步骤C补充完整。
| A.用量筒准确量取所需的浓硫酸,沿玻璃棒倒入盛有适量水的烧杯中。并用玻璃棒不断搅拌至冷却 |
| B.将烧杯中的硫酸沿玻璃棒注入所选的容量瓶中① |
| C._______________________________________________________________________ |
| D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处 |
E.改用胶头滴管滴加,直至凹液面刚好与刻度线相切
F.将容量瓶盖紧,振荡,摇匀
(4)若实验遇到下列情况,会导致硫酸溶液的物质的量浓度偏低的是__________(填序号)
①用以稀释硫酸的烧杯未洗涤
②量取浓硫酸的量筒未洗涤
③摇匀后发现液面低于刻度线再加水
④容量瓶中原有少量蒸馏水
⑤定容时观察液面俯视
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、冰醋酸,D中放有饱和碳酸钠溶液。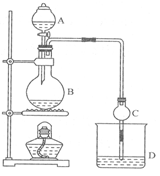
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:___________________ _____。
(2)球形干燥管C的作用是____________________________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)_______________________;反应结束后D中的现象是_________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;然后再进行 (此空从下列选项中选择)_________操作,以得到较纯净的乙酸乙酯:
A.淬取 B.蒸发 C.蒸馏 D.分液
某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。求:
(1)该有机物的分子式。
(2)红外光谱测定,A分子结构中含有苯环和羟基,能与烧碱反应,且在常温下A可与浓溴水反应,1molA最多可与2molBr2作用,据此确定该有机物的结构简式。