铝热反应在工业上有广泛应用:2Al+ Fe2O3 2Fe + Al2O3 。在该反应中,作为氧化剂的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了 2mol Fe,则需消耗 mol Al。
2Fe + Al2O3 。在该反应中,作为氧化剂的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了 2mol Fe,则需消耗 mol Al。
发生天然气井喷事故中喷发出的天然气含有硫化氢气体,请你用学到的知识回答下列问题:
(1)为防止井喷事故中更大的人员伤亡,抢救人员欲采用点火燃烧方法来除去有毒气体,试写出反应的化学方程式
(2)在石油钻井中,为防止井喷事故,要根据井下压强,将重晶石(密度4.5g/cm3左右)与泥浆按一定比例混合后灌入井中。写出重晶石的化学式试说明重晶石粉做压井材料的原因
(3)含硫地区钻井液的pH值应控制9.5以上,若用氢氧化钠溶液做控制液,写出发生反应的化学方程式
亚硝酸钠(NaNO2)是一种工业用盐,有像食盐一样的咸味,常被误食引起中毒。已知氢碘酸(HI)与NaNO2反应生成碘单质和一氧化氮气体。
(1)上述反应的离子方程式为。
(2)上述反应中,氧化剂是,发生氧化反应的物质是。
(3)根据上述反应,可以用试纸和生活中常见的物质进行实验,来鉴别亚硝酸钠和食盐。可选用的物质有:①自来水②碘化钾淀粉试纸③淀粉④白糖⑤食醋⑥白酒。进行实验时,必须选用的物质有(填写序号)。
将pH=13和pH=11的氢氧化钠溶液等体积混合,求混合后溶液的pH= 。
(12分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示:
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)且已知铝土矿中的Fe2O3全部转入赤泥。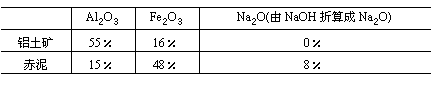
(1)生产中每消耗1t铝土矿将产生多少吨赤泥?
(2)试计算出每炼1t铝,理论上需要多少吨铝土矿?
将FeSO4·a(NH4)2SO4·bH2O的晶体9.6g与过量的氯化钡溶液反应,生成11.417gBaSO4;然后加入足量浓NaOH溶液并加热,产生的氨气用100ml 1mol/L盐酸吸收,剩余的盐酸再用2mol/LNaOH溶液中和,需NaOH溶液25.5ml。则
(1)9.6g晶体中SO42—离子的物质的量是_________________________
(2)晶体化学式中a、b的值是(均取整数):a=________;b=____________